Synthèses de
savons.
Première synthèse.
On se propose de réaliser la synthèse d’un savon. Pour ce faire, on
cherche à élaborer un protocole de synthèse du savon à partir d’un mode
opératoire trouvé sur Internet qui permet d’obtenir des acides gras et
du glycérol à partir d’huile d’olive.
Mode opératoire :
- Peser 5 g d’huile, les placer dans un ballon ; réaliser un montage à
reflux.
- Ajouter 50 mL de solution de soude alcoolique à 40 g.L
-1.
- Porter à reflux pendant 15 minutes.
- Éliminer environ 30 mL d’alcool (éthanol) par distillation simple.
- Dissoudre le concentrat dans 150 ml d’eau chaude, le mélange mousse à
l’agitation.
- Acidifier avec HCl à 12%. Contrôler au papier pH.
- Tiédir jusqu’à ce que les acides gras se séparent.
- Transvaser dans une ampoule à décanter.
- Retirer la couche aqueuse.
- Après évaporation de l’eau, on obtient 0,41 g de glycérol.
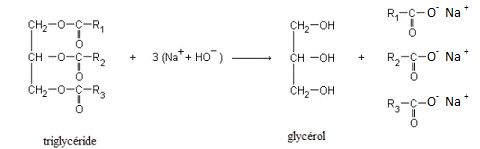
Les acides gras qui peuvent être obtenus à partir de l’huile d’olive
sont :
- l’acide palmitique C
15H
31COOH
- l’acide stéarique C
17H
35COOH
- l’acide oléique C
17H
33COOH
- l’acide linoléique C
17H
31COOH
Schématiser
les différentes étapes du mode opératoire et modéliser, par des
réactions, les transformations mises en oeuvre. Indiquer la composition
des différentes phases présentes dans chacune des étapes.
Chauffage
à reflux : 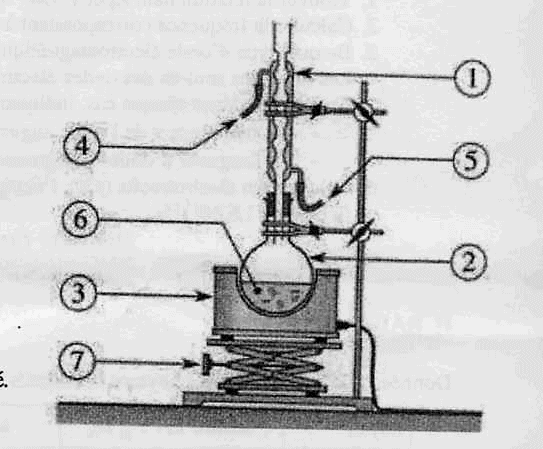
1 : réfrigérant à eau ; 2 : ballon ; 3 : chauffe ballon
; 4 : sortie de l'eau ; 5 : entrée de l'eau ; 6 : mélange réactionnel (
huile + solution de soude alcoolique ) ; 7 : élévateur à croisillons.
Distillation
simple :
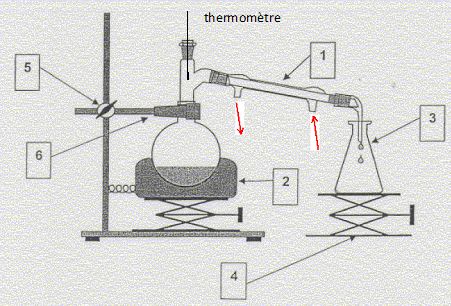
1 : réfrigérant à eau ; 2 : chauffe ballon ; 3 :
erlenmeyer ; 4 : élévateur à croisillons ; 5 et 6 : pince, noix,
potence.
Le distillat contient l'éthanol ; état final dans le ballon : glycérol,
ion carboxylate et ion sodium, éthanol résiduel, ion hydroxyde en
excès.
Ampoule à décanter
: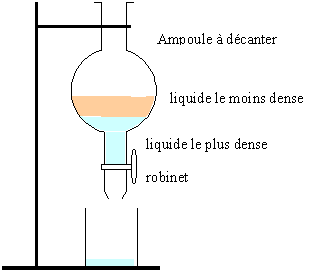
La phase inférieure contient la solution aqueuse et le glycérol ; la
phase supérieure contient les acides gras obtenus lors de l'ajout
d'acide chlorhydrique.
Citer
deux applications du glycérol.
Agent hydratant dans les cosmétiques ; lubrifiant dans les
suppositoires ; industrie des explosifs ( nitroglycérine ).
Corriger
les éventuels écueils scientifiques présents dans le texte et apporter
les compléments nécessaires pour pouvoir proposer ce protocole en TP à
des élèves de lycée.
"millilitre s'écrit mL et non pas ml.
Solution d'acide chlorhydrique plutôt que HCl.
Incohérence des chiffres significatifs : il faudrait écrire 5,0 g
d'huile.
" les acides gras se séparent " : il vaudrait mieux écrire " les acides
gras insolubles dans l'eau et moins denses que l'eau se
rassemblent à la partie supérieure du liquide".
Compléments : donner les schéma du montage à reflux et de la
distillation simple.
Lors de la décantation, agiter et dégazer en ouvrant le robinet.
Donner les pictogrammes de sécurité ; port de gants, blouse et
lunettes pour manipuler l'acide chlorhydrique.
Rédiger un protocole
de synthèse d'un savon adapté à la classe de 3è et au
matériel disponible au collège.
Dans le ballon de 250 mL, introduire
10 g de soude, 20 mL d’huile d’olive
et 20 mL d’éthanol.
Adapter un réfrigérant à air sur le ballon et chauffer le
mélange réactionnel pendant 15 minutes au bain marie.
Le volume d'huile est mesuré à l'aide d'une éprouvette graduée.
Verser
le contenu du ballon dans un verre à pied
contenant de l’eau salée afin de faire précipiter le savon. C’est ce
qu’on
appelle le « relargage ».
Filtrer le mélange ontenu et sécher les morceaux de savon obtenu.
Prélever un peu du savon obtenu et l'introduire dans un tube
à essais. Ajouter
de l'eau et agiter. De la mousse se forme, le produit possède des
propriétés détergentes.