Composition d'une lessive :
tensioactif, azurant, enzyme.
Concours Caplp maths sciences
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
Le savon.
Proposer
une expérience simple qui montre les effets du savon sur la tension
superficielle de l'eau.
On
qualifie une espèce chimique amphiphile de tensioactif en raison de son
action sur la tension de surface d'un liquide. Pour montrer le
phénomène
de tension de surface et l'effet d'un tensioactif, une expérience
simple peut être réalisée avec un trombone, un cristallisoir, de l'eau
et du liquide vaisselle.
La
tension superficielle est la force qu'il faut appliquer à un liquide
pour provoquer l'extension de sa surface.
Tout objet en contact avec la surface d’un liquide est soumis à une
force de tension superficielle exercée par le liquide.
On pose doucement un trombone à la surface de l'eau, puis on ajoute du
liquide vaisselle : le trombone coule.
Décrire
sous forme de schémas annotés l'action d'un détergent sur une salissure.
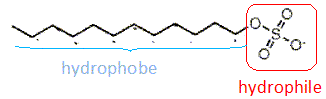
Les
tensioactifs sont des espèces chimiques amphiphiles constituées d'une
partie hydrophile et d'une partie hydrophobe ( lipophile).
Hydrophile
: ami de l'eau ( qui a une affinité pour l'eau ) ; hydrophobe :
ennemi de l'eau ; amphiphile : l'espèce possède à la fois une partie
amphiphile et une autre partie hydrophobe.
Structure
générale des tensioactifs.
 Propriétés détergentes d'un
tensiactif
Propriétés détergentes d'un
tensiactif.
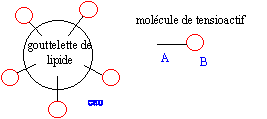
La partie B se trouve dans l'eau : partie
hydrophile du tensioactif.
Proposer
une rémédiation à l'erreur d'expérimentation présentée dans le document
suivant.
Un professeur décide de
fabriquer un savon par saponification d'un corps gras. Dans un ballon,
équipé d'un dispositif de chauffage à reflux, il introduit 10 g
d'un composé A et 20 mL d'un composé B e concentration cb,
10 mL d'éthanol et quelques grains de pierre ponce. Le mélange est
chauffé pendant 40 min. A l'issue de ce chauffage, le mélange
réactionnel ne prend pas en masse comme il s'y attendait.
Etape
2 : préparer un becher de 100 mL d'eau et 20 g de chlorure de
sodium ;
à la fin du chauffage verser
le mélange chaud dans le becher contenant l'eau salée froide.
Etape 3 :
fFiltrer sur Büchner ; récupérer le savon et sécher.
Le montage expérimental utilisé lors de la première étape de la
préparation d'un savon est schématisé ci-dessous :
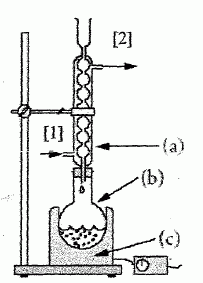
Nommer les trois
éléments a, b et c du montage.
a : réfrigérant à eau ; b :
ballon ;
3 : chauffe ballon.
Donner la
signification des deux flèches 1 et 2 indiquées sur le
montage.
1 : entrée de l'eau ; 2 : sortie
de l'eau.
Proposer
les noms d'usage courant des réactifs A et B, préciser le rôle de
l'éthanol et de la pierre ponce.
A est un triglycéride ou une huile de table ; B est de l'hydroxyde de
sodium ou de potassium. L'huile est très peu soluble dans l'eau,
beaucoup plus dans le mélange eau éthanol. Les réactifs se trouvent
ainsi dans la même phase.
La pierre ponce régularise l'ébullition.
Préciser
les caractéristiques de cette réaction. De quelles manières peut-on
rendre totale une réaction partielle ?
La saponification est lente, mais totale.
En utilisant un excès de réactif ou en éliminant l'un des produits au
fur et à mesure de son apparition, on déplace l'équilibre dans le sens
direct d'une réaction partielle.
|
| .
. |
|
|
Les azurants
optiques.
En classe de seconde, l'enseignant propose aux élèves d'identifier par
chromatographie la présence d'azurants optiques dans les lessives.
Expliquer
le principe de la chromatographie sur couche mince.
La
chromatographie sur couche mince ( CCM) permet de déparer et
d'identifier les constituants d'un mélange.
Il faudra
deux espèces pures, l'acide salicylique et l'aspirine, servant de
référence. Le troisième dépôt sera réalisé à partir du milieu
réactionnel.
Si les espèces sont incolores, mais absorbe dans le proche UV, on peut
les révéler sous lampe UV.
|
éluant : mélange cyclohexane acétone
Sur la plaque de silice on effectue trois dépôts à
l'aide de capillaires
A : cristaux obtenus par synthèse
B : aspirine pure ; C : acide salicylique
Après révélation sous lampe UV ( 254 nm) on
obtient le chromatogramme ci-contre, en cours de synthèse.
|
en cours de synthèse :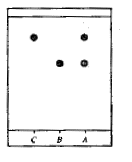
|
à l'état final.

|
Expliquer à l'aide
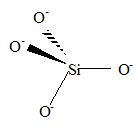
d'un schéma la structure tétraèdrique de l'ion silicate SiO44-.
Les atomes d'oxygène se disposent le plus loin possible des uns des
autres : dans ce cas les répulsions entre charges négatives sont
minimales. La géométrie tétraèdrique permet de minimiser ces répulsions.
Déterminer
le degré d'oxydation du silicium dans l'ion silicate.
n.o(Si) + 4*(-2) = -4 ; n.o(Si )= 4.
Expliquer
le phénomène optique mis en jeu lorsque les molécules d'azurants
optiques sont déposées sur le linge au cours du lavage.
Les
azurants optiques s'accrochent aux fibres textiles, absorbent le
rayonnement ultraviolet et le réémettent en lumière visible par
fluorescence, ce qui donne au linge une coloration légèrement bleutée
et renforce l'impression de blancheur.
Décrire
le spectre continu correspondant à une lumière blanche.

On
observe un spectre continu contenant toutes les couleurs de l'arc en
ciel.
Proposer
un scénario pédagogique permettant d'expliquer à des élèves de première
bac pro la couleur des objets.
Comment sont obtenues les couleurs sur un écran d'ordinateur ?
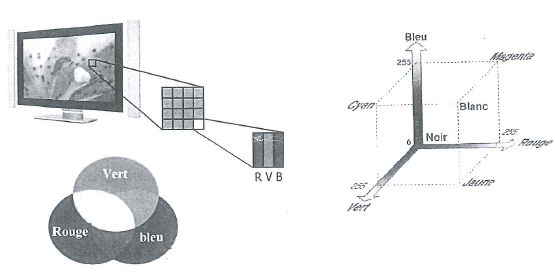
Le
mode de représentation RVB( rouge, vert, bleu ) est le plus utilisé
pour la restitution de l'image. L'image est composée d'une matrice de
points appelés pixels. Un
pixel est composé de trois couleurs ( le rouge, le vert, le bleu). Le
mode de composition des couleurs se fait par addition des couleurs. En
jouant sur l'intensité de chacune d'elle, on peut recréer les autres
couleurs.
La
rétine de l'oeil contient 3 types de cônes sensibles soit à la
lumière rouge, soit au vert soit au bleu ainsi que des bâtonnets
sensibles à l'intensité lumineuse. La perception des couleurs par la
rétine utilise le principe de la trichromie.
La synthèse additive résulte de la superposition de lumières colorées.
En superposant des lumières colorées, le cerveau en perçoit une
nouvelle.
Expériences
: superposer les trois lumières primaires, agir sur leur intensité
lumineuse respective et noter la couleur perçue.
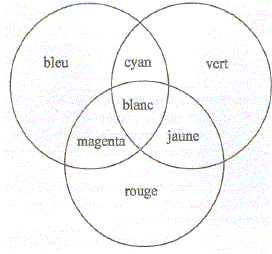
Les couleurs
sont dites complémentaires si leur synthèse additive donne du blanc.
* l'addition des trois couleurs primaires donne du blanc * l'absence de
couleur donne du noir
* l'addition de deux couleurs primaires conduit aux couleurs
secondaires :
rouge +
vert donnent le jaune ; rouge + bleu donnent le magenta ; bleu + vert
donnent le cyan
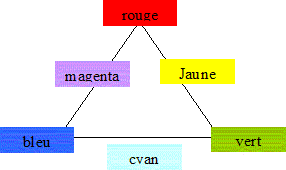
|
Un corps éclairé en lumière blanche est jaune
car :
• il absorbe toutes les couleurs sauf le jaune.
• il renvoie toutes les couleurs
sauf le bleu, couleur complémentaire du jaune.
|
La
couleur perçue lorsqu'on observe un objet dépend de l’objet lui-même et
de la lumière qui l’éclaire.
Tableau d’observation :
|
couleur de l'objet en lumière blanche
|
couleur d'éclairage
|
couleur observée
|
|
rouge (absorption du vert et du bleu ;
diffuse le rouge
|
jaune( soit rouge + vert)
|
rouge
|
|
rouge
|
vert ou bleu
|
noir
|
|
blanc ( diffuse toutes les couleurs)
|
rouge + bleu
|
magenta
|

Le cyan est
la couleur complémentaire du rouge.
Indiquer la couleur de la tomate éclairée en lumière rouge.
La tomate diffuse le rouge ; elle absorbe le bleu et le vert.
Eclairée en lumière rouge, elle paraît rouge.
Eclairée en lumière bleue, indiquer pourquoi la tomate paraît noire.
La tomate absorbe le bleu ; éclairée en lumière bleue, elle absorbe
cette lumière et ne diffuse aucune lumière : elle paraît noire.
Argumenter
des avantages et des inconvénients de l'usage de logiciel de simulation
dans l'expérimentation.
La simulation doit compléter l'expérience. La simulation permet de
développer chez l'élève une meilleure compréhension des sciences
expérimentales : un élève peu se familiariser avec un modèle complexe
et étudier les conséquences en modifiant toutes sortes de conditions.
Mais un modèle a des limites de validité et si on en sort on peut
aboutir à des absurdités.
|
.
Compléter les
structures du a-D-glucose en
faisant apparaître les substituants pour les deux rerésentations de
Cram et stéréochimique.
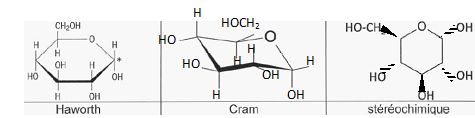
Donner la
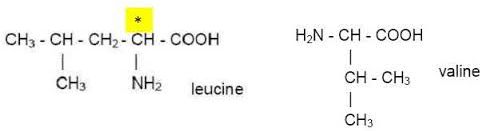
configuration R ou S du carbone asymétrique repéré par un astérisque.
Numéroter de façon décroissante chacun des quatre
substituants selon
son numéro atomique.
On place alors l'atome (ou le groupement) de numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).
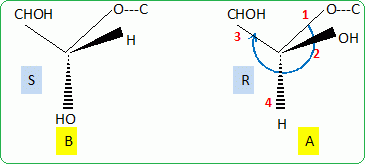
Le carbone n°1 est S.
Préciser le nom de
la liaison formé entre deux molécules de glucose au sein de l'amidon.
La liaison osidique est une liaison covalente entre un groupe hydoxyle
du carbone hémiacétalique d'un ose et un groupe acide ( hydrogène
libre) d'une autre molécule.
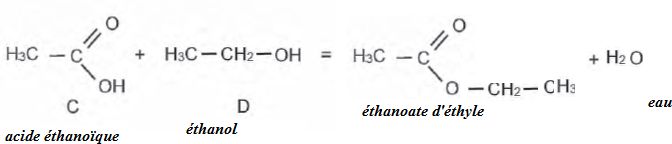
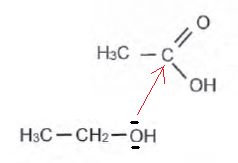
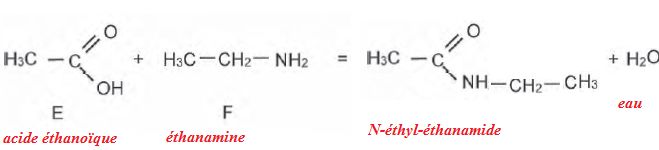
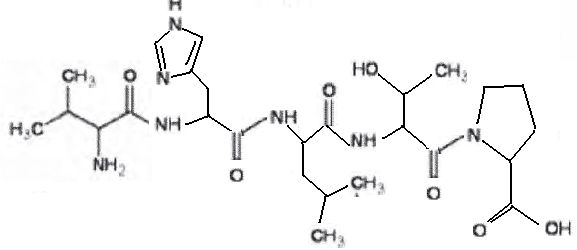
Expliquer
en quelques lignes le mode d'action des enzymes dans les lessives.
Les enzymes dégradent les molécules organiques en conduisant à des
molécules plus petites. Les enzymes sont efficaces en petite quantité
et à basse température. Ce sont des catalyseurs permettant d'utiliser
moins de lessive.
|