Dosages d'espèces
azotées : Kjeldahl, polarographie : concours assistant d'ingénieur 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Dosage de
l’azote par la méthode de Kjeldahl.
Données : Acide métaborique pKa = 9.2 ; Zones de virage
Hélianthine 3,1 – 4,4 ; Bleu de bromothymol 6,0 - 7,6 ;
Phénolphtaléine 8,2 - 10,0 ; Urée (N2H4CO) Masse
molaire : 60 g.mol-1.
Les étapes de la méthode sont la minéralisation, la distillation et le
dosage. Lors de la minéralisation, l’azote organique est converti en
ions NH4+.
Quel
réactif utilise-t-on lors de l’étape de minéralisation.
Oxydation à ébullition avec de l'acide sulfurique concentré.
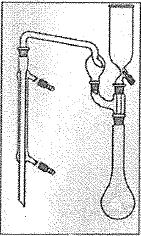
Le schéma suivant
décrit l’appareillage que l’on peut utiliser pour l’étape de
distillation.
De la soude concentrée peut être ajoutée par le haut.
Le minéralisât peut être chauffé.
L’allonge trempe dans une solution d’acide métaborique HBO2.
Expliquer le rôle de
la soude, du chauffage et de la solution d’acide métaborique.
La soude neutralise l'acide sulfurique et transforme l'ion ammonium en
ammoniac NH3.
Les vapeurs d'ammoniac sont entraînées par la vapeur d'eau lors de la
distillation. Ces vapeurs sont condensées ; l'acide borique retient
l'ammoniac sous sa forme ion ammonium.
|
 |
Lors de l’étape de dosage,
le contenu du becher est dosé par une solution d’acide chlorhydrique.
Quel
indicateur coloré choisir pour repérer l’équivalence ?
NH 3
+ H 3O + --> NH 4+ +H 2O.
Le mélange à l'équivalence contient un acide faible, l'ion ammonium. Le
pH étant inférieur à 7 et la zone de virage de l'indicateur coloré
devant contenir le pH à l'équivalence, on choisira le rouge de méthyle
ou l'hélianthine.
On
désire vérifier la teneur en azote d’une solution d’urée pour laquelle
on sait que la concentration massique est de l’ordre de 30 g.L-1.
On dispose d’une solution d’acide métaborique de concentration connue
0,500 ± 0,002 mol.L-1 (k = 2) et d’une solution d’acide
chlorhydrique de concentration 0,500 ± 0,002 mol.L-1
(k = 2) ainsi que des réactifs nécessaires au protocole. La burette
employée contient 25 mL. On souhaite un volume équivalent à 20 mL.
Quel
volume d’urée faut introduire au départ ? Quel volume minimal de
solution d’acide métaborique faut-il placer dans le becher ?
Quantité de matière d'acide chlorhydrique : 0,020*0,500 =0,010 mol.
Quantité de matière d'ammoniac dosé : 0,010 mol ; masse d'élément azote
: 0,010*14= 0,14 g.
Masse d'urée correspondante : 0,14*60 /28 =0,3 g.
Volume de solution d'urée : 0,3/30 =0,01 L environ 10 mL.
Volume minimal de solution d'acide métaborique : 0,010 /0,5 = 0,020 L
=20 mL.
Le volume équivalent mesuré est de 19,80 mL. Quelle
est le titre molaire en urée de la solution inconnue ? Procéder au
calcul d’incertitude sur ce titre et présenter le résultat final.
Indiquer également le titre massique accompagné de son incertitude.
Quantité de matière d'acide
chlorhydrique : 0,0198*0,500 =9,9 10-3 mol.
Quantité de matière d'ammoniac dosé : 9,9 10-3 mol.
Masse d'élément azote : 9,9 10-3*14= 0,1386 g.
Masse d'urée correspondante : 0,1386 *60/28 =0,297 g ou 4,95 10-3
mol dans une prise de 10 mL.
Concentration molaire de l'urée : 4,95 10-3
/0,010=0,495 mol/L.
|
| .
. |
|
|
Dosage
polarographique des ions nitrate.
Le protocole de dosage des ions nitrate donné par un fabricant de
polarographes indique que cette méthode est particulièrement adaptée
car insensible aux interférences chimiques.
Quelle
méthode permet en général de s’affranchir des interférences chimiques
dans un dosage ?
Dosage par étalonnage interne : on ajoute une quantité parfaitement
connue et unique, dans
toutes les solutions étalon et tous les échantillons, une molécule qui
sert de référence durant les phases de l’analyse.
Le
protocole indique que le sel de fond à ajouter à chaque échantillon de
50 mL est composé essentiellement de 5 mL d’acide sulfurique concentré.
Un temps de purge de 300 s est recommandé. Le dispositif expérimental
comporte une réserve de mercure reliée à un capillaire sur lequel vient
frapper un marteau.
Quelles
raisons justifient l’utilisation d’une électrode de mercure ?
La surface de l'électrode est constamment renouvellée : on obtient des
courbes parfaitement reproductible du fait de l'élimination de la
substance déposée.
Le mercure
est inaltéré en milieu acide ou basique et possède une forte surtension
: le solvant ne sera pas électrolysé.
Les courants étant très faibles ( quelques mA) une petite partie
de la substance subit la réaction électrochimique et sa concentration
en solution reste constante.
Faire
un schéma de principe du montage représentant le vase à réaction, les
électrodes et leur nature, le générateur, l’ampèremètre et le voltmètre.
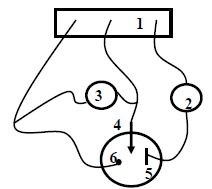
(1)
: potentiostat ; (2) milliampèremètre en série ; (3) voltmètre en
parallèle ; (4) électrode de travail ; (5) électrode auxiliaire en
platine ; (6) électrode de référence.
|
.
|
|
Quels
sont les 3 types de courant existant lors d’une électrolyse ? Lequel
est mesuré en polarographie ? Quelles conditions expérimentales
permettent d’annuler les deux autres contributions ?
Réduction à la cathode négative et oxydation à l'anode positive
avec échange d'électrons entre espèces réagissantes et électrodes.
Migration des ions au sein de la solution sous l'action du champ
électrique.
Diffusion des ions au voisinage des électrodes afin d'annuler les
écarts de concentrations.
Transport pas convection dû à l'agitation ou aux différences de
température au sein de la solution.
En polarographie le courant est contrôlé par la diffusion et on utilise
un large excès d'un électrolyte indifférent ( sel de fond ) pour
s'affranchir des phénomènes dus à la migration.
Une analyse est effectuée en polarographie impulsionnelle classique sur
une solution d’ions nitrate contenant le sel de fond.
Expliquer
l’existence d’un palier sur la courbe.
La hauteur du palier de diffusion est proportionnelle à la
concentration de l'espèce. On observe un palier lorsque la vitesse de
diffusion de s ions est égale à la vitesse de réaction.
S’agit-il
de vagues d’oxydation ou de réduction ?
On observe des réactions de réduction sur l'électrode de mercure. les
potentiels sont limités du côté positif vers 0,4 V à cause de
l'oxydation du mercure.
Expliquer
l’existence des deux vagues b-1 et b2. Justifier à l’aide des courbes
le rôle de la purge. Comment est-elle réalisée expérimentalement
?
On dégaze les solutions en faisant un barbotage avec un gaz inerte,
l'azote afin d'éliminer le dioxygène dissout qui serait réduit dans le
domaine des potentiels considérés.
Le courant d'azote est maintenu au dessus de la solution pendant tout
le tracé du polarogramme.
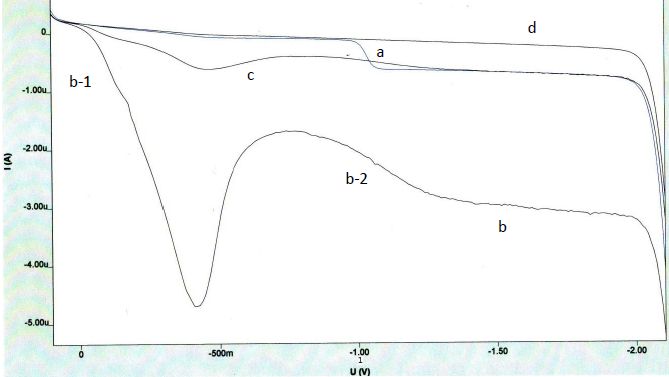
a : solution contenant des ions nitrate et le sel de fond. Purge : 300s
b : solution contenant uniquement le sel de fond. Purge 0s
c : solution contenant uniquement le sel de fond. Purge 60s
d : solution contenant uniquement le sel de fond. Purge 300s
La courbe b présente un pic. Comment le faire
disparaitre expérimentalement ?
Les pics résultent des courants de convection autour de la goutte de
mercure en expansion. Des surfactants comme la gélatine suppriment ces
variations de tension superficielle.
|
|
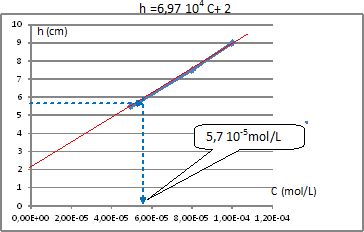
Exploiter le graphe
suivant pour déterminer la concentration inconnue.
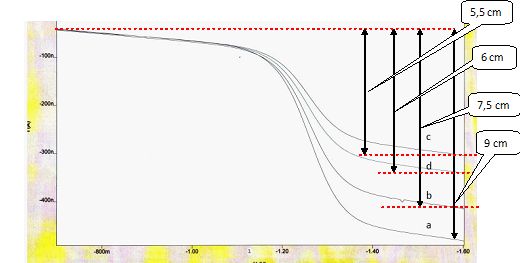
a : solution contenant des ions nitrate à 10-4 mol.L-1
et le sel de fond. Purge : 300s
b : solution contenant des ions nitrate à 8.10-5 mol.L-1
et le sel de fond. Purge 300s
c : solution contenant des ions nitrate à 5.10-5 mol.L-1
et le sel de fond. Purge 300s
d : solution inconnue contenant le sel de fond. Purge 300s
On doit tracer une courbe étalon. On reporte la hauteur de la vague en
fonction des concentrations et on mesure la hauteur correspondant à
l’échantillon à doser.
|
| |
|