Etude d'un système
binaire : concours assistant d'ingénieur 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Suite
à l’étude de l’équilibre liquide-vapeur du mélange binaire formé de
dioxane (constituant A) et d’isopropanol (constituant B) sous la
pression atmosphérique, on dispose du diagramme binaire suivant :
En absice, XB correspond à la fraction molaire en Isopropanol pour le liquide et YB à la fraction molaire en Isopropanol pour la vapeur ; en ordonnée a été placée la température.
Indiquez sur le diagramme les domaines de stabilité de chaque phase ainsi que le nom de chacune des deux courbes.
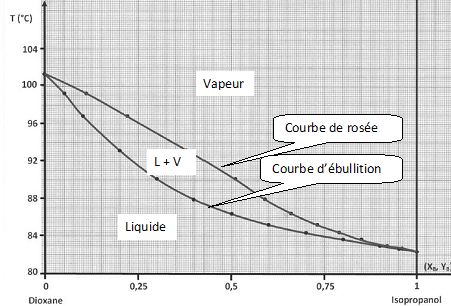
Pourquoi peut-on dire qu’on est en présence d’un système binaire avec miscibilité totale en phase liquide ?
L e diagramme présente un seul fuseau.
D’après
le diagramme, qu’elle est la température d’ébullition du dioxane pur
sous la pression atmosphérique ? Quel est le liquide le plus volatil ?
La température d'ébullition du dioxane pur est voisine de 101°C, celle de l'isopropanol de 82,2°C ; ce dernier est le liquide le plus volatil.
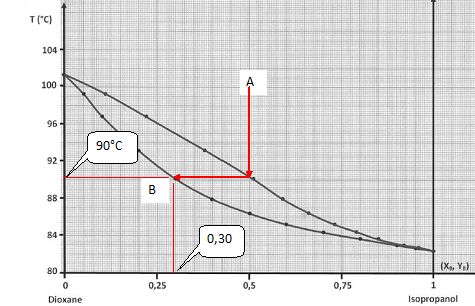
Un mélange gazeux de fraction molaire YB = 0,5 en isopropanol et de température égale à 100 °C est refroidi lentement et de façon régulière. A
quelle température apparaitra la première goutte de liquide ? Quelle
sera la fraction molaire en isopropanol de cette première goutte de
liquide ?
|
| .
. |
|
|
On considère un liquide de fraction molaire en isopropanol XB = 0,4. On sait qu’initialement ce liquide contient en tout 1000 moles. On porte ce mélange à une température de 90 °C. En appliquant le théorème des moments, déterminez le nombre de moles dans la phase liquide et dans la phase gazeuse.
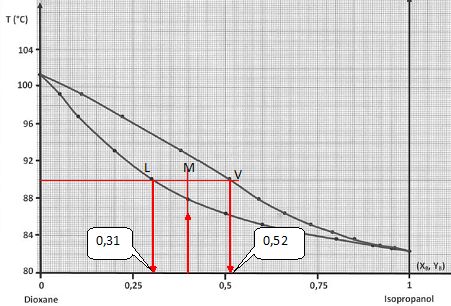
On note nV la quantité de matière de vapeur et nL la quantité de matière de liquide.
Théorème des moments chimiques : nV MV = nL ML.
D'après le graphe ML =0,4-0,31 = 0,09 et MV =0,52-0,4 = 0,12 ; par suite : 0,12 nV = 0,09 nL.
nV = 0,09/0,12 nL =0,75 nL.
de plus nV+nL = 1000 ; 1,75 nL = 1000 ; nL ~571 moles ; nV =429 moles.
|
.
|
|
On sait qu’un mélange, chauffé à une température de 93 °C, contient en mole trois fois plus de vapeur que de liquide.
En utilisant le théorème des moments, déterminez la fraction molaire en isopropanol de ce mélange.
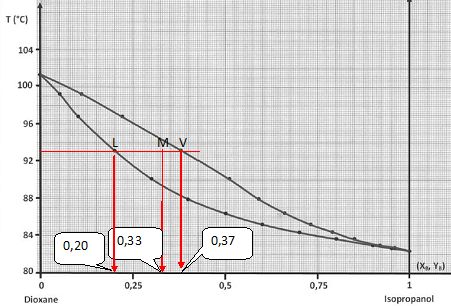
nV = 3nL ; théorème des moments chimiques : nV MV = nL ML soit 3 nL MV =nLML ; ML = 3 MV.
|
|
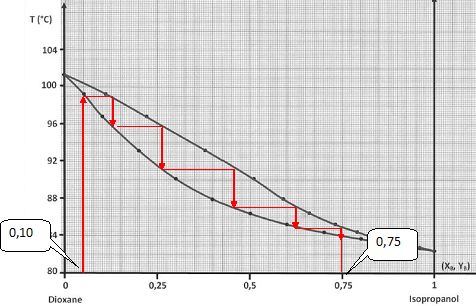
On distille un liquide de fraction molaire en isopropanol XB = 0,1.
Quel
nombre de plateaux théoriques doit contenir la colonne pour obtenir une
vapeur telle que la fraction molaire en isopropanol YB = 0,75 ? 5 plaeaux théoriques.
|
| |
|