Un alcool de formule brute C4H100
a quatre isomères que l'on désignera par A, B, C, D. On dispose de
trois de ces isomères A, B, C. On effectue avec chacun d'eux un essai
d'oxydation par une solution de permanganate potassium en milieu acide.
( K+ + MnO4- ) A donne le composé A1;
B ne réagi pas ; C donne le composé C1.
Ecrire les forniules
semi-développées
des quatre isomères. Donner leur nom et leur classe.
Quel est, des quatre
isomères A, B, C, D, celui qui ne subit pas
d'oxydation ménagée ? Pourquoi ?
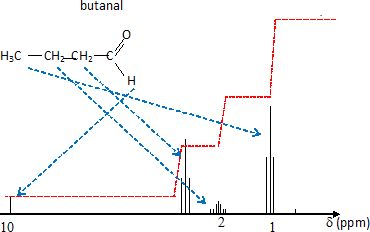
CH3-CH2-CH2-CH2OH butan-1-ol alcool
primaire (noté C1) peut
s'oxyder en aldehyde ( butanal H3C-CH2-CH2-CHO)
puis en acide butanoïque H3C-CH2-CH2-COOH.
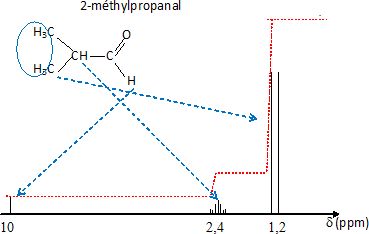
CH3-CH(CH3)-CH2OH
2-méthylpropan-1-ol alcool primaire
peut s'oxyder en aldehyde (
2-méthylpropanal CH3-CH(CH3)-CHO )
puis en acide 2-méthylpropanoïque H3C-CH(CH3)-COOH.
CH3-CH(OH)-CH2-CH3
butan-2-ol alcool secondaire (noté A1)
peut s'oxyder en cétone butanone CH3-CO-CH2-CH3
CH3-C(CH3)2-OH
2,2diméthylpropan-2-ol
alcool tertiaire, pas d'oxydation ménagée.( noté B).
On soumet ensuite les composés A1
et C1 à deux tests :
- test 1 à la 2,4-D.N.P.H et test n°2 à la liqueur de Fehling
- A1 : test 1 positif et test 2 négatif
- C1 : les deux tests sont positifs.
Qu'observe-t-on
dans le test 1? Quel groupe fonctionnel met-on en
évidence? Quels sont les corps possédant ce groupe fonctionnel ?
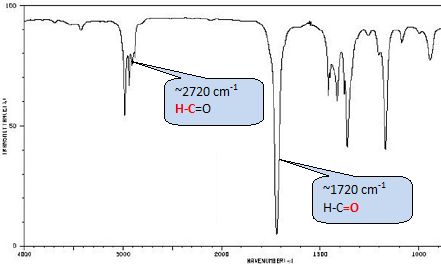
Le test 1 met en évidence du
groupe carbonyl C=O des aldehyde et cétone ( formation d'un solide
jaune).
Quelle propriété
met-on en évidence par le test 2 ? A quelle fonction
du composé C1 correspond ce test
?
Le test
2 met en évidence un aldehyde réducteur
(formation d'un solide rouge Cu2O).