Synthèse
d'un anesthésique : la benzocaïne.
Bac S Antilles 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
La
benzocaïne (4-aminobenzoate d’éthyle) est utilisée en médecine comme
anesthésique local
d’usage externe. Elle est présente dans des crèmes pour le traitement
des coups de soleil, mais
on la trouve aussi dans de nombreuses autres préparations : pastilles
contre les maux de gorge,
produits gingivaux contre les douleurs dentaires.
Dans le cadre d’un projet de recherche, demandé en premier cycle
universitaire, on envisage de
synthétiser de la benzocaïne. Pour cela, quatre grandes tâches devront
être réalisées :
· l’étude bibliographique préliminaire ; la vérification de
la pureté d’un réactif ; la réalisation de la dernière étape
de la synthèse et l’évaluation de son rendement ;
l’identification du produit obtenu.
Données
:
· Masse molaire moléculaire en g.mol-1 : éthanol
: 46,0 ; benzocaïne : 165,2 ;
acide 4-aminobenzoïque : 137,1. · Masse volumique de l’éthanol : 0,79
g.mL-1.
pKa1 (NH3+-C6H4-COOH(aq)
/ NH3+-C6H4-COO-(aq))
= 2,5.
· pKa2 (NH3+-C6H4-COO-(aq) / NH2-C6H4-COO-(aq) = 4,9.
· Degré de pureté d’une espèce chimique : rapport de la masse de cette
espèce chimique
présente dans un échantillon sur la masse de cet échantillon
Étude bibliographique
préliminaire.
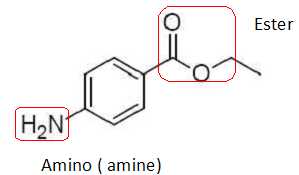
Représenter sur votre copie la molécule de benzocaïne.
Entourer les groupes caractéristiques
présents, puis nommer les familles chimiques correspondantes.
La molécule de benzocaïne présente-t-elle des énantiomères ou des
diastéreoisomères ?
Justifier.
Pas de carbone asymétrique : donc pas d'énantiomères.
Pas de double liaison C=C :donc pas de diastéréoisomères Z / E.
Pourquoi l’étape (a) de la synthèse de la benzocaïne peut-elle
être classée dans la catégorie
des réactions de substitution ?
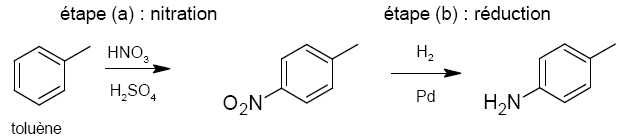
Un atome d'hydrogène du cycle est remplacé par le groupe nitro NO2.
L’étape (b) fait intervenir un métal, le palladium (Pd), en tant
que catalyseur. Indiquer les
propriétés d’un catalyseur.
Un
catalyseur accélère une réaction thermodynamiquement posible. Etant
régénéré dans la dernière étape du mécanisme réactionnel, il
n'intervient pas dans le bilan. Un catalyseur est sélectif :
lorsque deux issues sont possibles, il peut orienter la réaction.
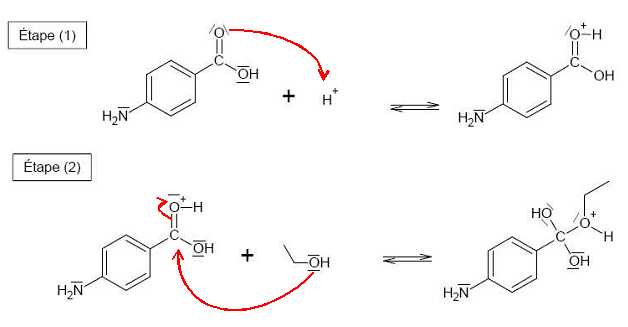
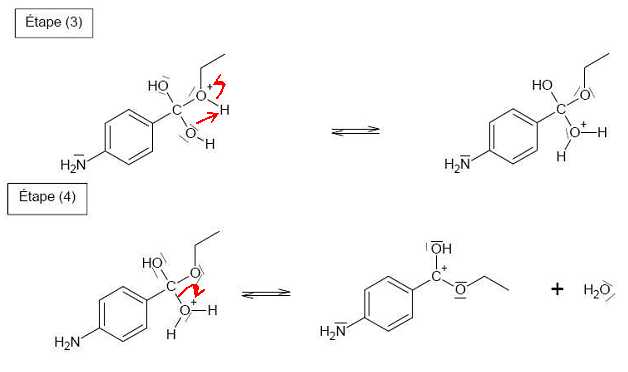
Compléter le mécanisme réactionnel de l’étape (d) (estérification), à l'aide de flèches
courbes.
|
| .
. |
|
|
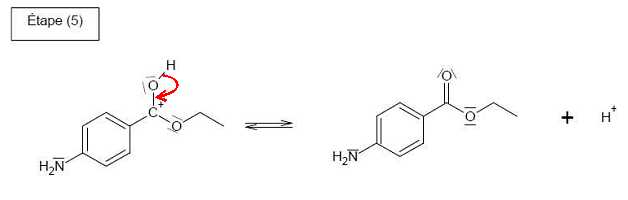 . .
|
.
|
|
Vérification de la pureté du réactif.
Pour
réaliser la synthèse de la benzocaïne, il faut que le réactif, l’acide
4-aminobenzoïque, ait un degré de pureté supérieur à 98 %.
On
dispose au laboratoire d’un flacon d’acide 4-aminobenzoïque dont la
pureté n’est pas indiquée. Afin de la vérifier, un dosage par titrage
est réalisé.
Pour cela, on prélève une masse m = 1,00 g de poudre
contenue dans le flacon. Cet échantillon est ensuite introduit dans une
fiole jaugée de 50,0 mL que l’on complète avec de l’eau distillée
jusqu’au trait de jauge en homogénéisant. La solution S obtenue a un pH
de 3,8. On titre cette solution S par une solution aqueuse d’hydroxyde
de sodium (Na+
(aq) + HO-(aq)) de concentration molaire CB = 5,00 x 10-1 mol.L-1.
On suit le titrage par pH-métrie. Le graphique représentant l’évolution
du pH en fonction du volume d’hydroxyde de sodium versé est représenté
ci-dessous :
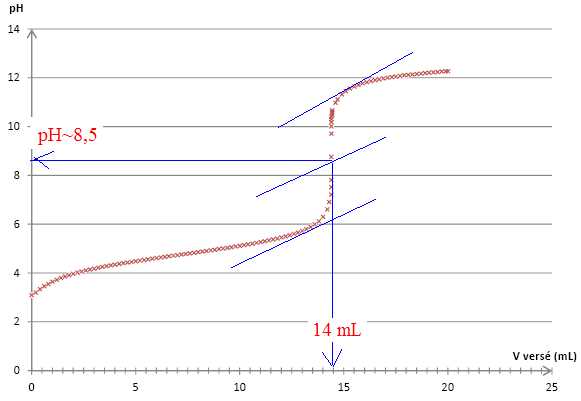
À l’aide du graphique précédent, déterminer le volume à l’équivalence en précisant la méthode utilisée.
La méthode des tangentes donne VE = 14 mL et pHE ~8,5.
Justifier que l’espèce chimique dosée dans la solution S est NH3+-C6H4-COO-(aq).
A pH supérieur à pKa1 et inférieur à pKa2, l'espèce NH3+-C6H4-COO-(aq) prédomine.
Sous quelle forme se retrouve l’espèce chimique dosée à la fin du titrage ?
Le pH final est proche de 12 ; à pH supérieur à pKa2, l'espèce NH2-C6H4-COO-(aq) prédomine.
Écrire l’équation chimique de la réaction support du titrage.
NH3+-C6H4-COO-(aq) +HO-aq ---> NH2-C6H4-COO-(aq) +H2O.
En déduire la concentration molaire de la solution aqueuse de l’acide 4-aminobenzoïque avec deux chiffres significatifs.
A l'équivalence VE Cb = CaVa ; Ca = VE Cb / Va= 0,500 *14 /50 =0,14 mol / L.
Une méthode plus précise conduit à la valeur C = 0,144 mol.L-1 pour la concentration molaire de l’acide 4-aminobenzoïque.
Le produit contenu dans le flacon peut-il être utilisé dans la synthèse envisagée ?
0,144 mol dans 1 L soit n =0,144 *0,0500 =0,0072 mol dans 50 mL.
Masse d'acide 4-aminobenzoïque : n M (acide 4-aminobenzoïque)= 0,072*137,1 =0,987 g dans 1 g du produit contenu dans le flacon
Degré de pureté : 0,987 ~0,99. ( 99 %). Le produit contenu dans le flacon peut être utilisé dans la synthèse.
|
Réalisation de la dernière étape de la synthèse et détermination de son rendement.
Dans
un ballon de 100 mL, introduire une masse m = 1,50 g de l’acide
4-aminobenzoïque solide et un volume V = 20,0 mL d'éthanol. Agiter
doucement le mélange, le ballon étant placé dans un bain
de glace et ajouter goutte à goutte 1 mL d’une solution concentrée d’acide sulfurique.
Chauffer à reflux pendant une heure, puis laisser revenir le mélange à température ambiante.
Après plusieurs étapes de séparation afin de récupérer le produit formé, on obtient un solide blanc qui est séché et pesé.
Montrer que la masse de benzocaïne, notée mthéorique, que l’on peut espérer former à l’issue de la synthèse vaut : mthéorique = 1,80 g.
Quantités de matière des réactifs : n(acide
4-aminobenzoïque) = m / M (acide 4-aminobenzoïque)= 1,50 / 137,1 = 0,0109 mol.
n (éthanol) = V réthanol / M(éthanol) =20,0 *0,79 / 46 =0,343 mol.
Une mole d'éthanol réagit avec une mole d'acide 4-aminobenzoïque : l'éthanol est en excés.
Quantité de matière de benzocaïne : n =0,0109 mol ; masse de benzocaïne = n M(benzocaïne) =0,0109 *165,2 =1,80 g.
En fin de synthèse, la masse de produit récupéré est mexpérimental = 0,81 g. Définir et calculer le rendement de cette réaction.
Rendement = mexpérimental / mthéorique =0,81 / 1,80 =0,45 ( 45%).
Identification du produit formé.
On
donne les spectres infrarouge de l’acide 4-aminobenzoïque et du produit
obtenu. Associer à chaque molécule son spectre IR en justifiant.
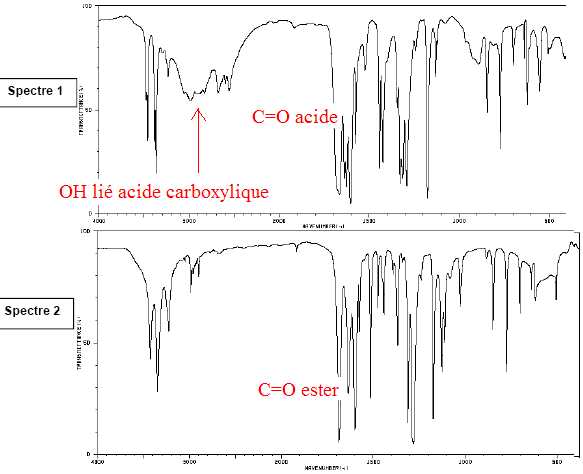
Le spectre 1 est celui de l'acide 4-aminobenzoïque et le spectre 2 est celui de la benzocaïne.
Vérifier, à l’aide du spectre RMN du produit obtenu, que l’étape d’estérification de la benzocaïne s’est bien déroulée.
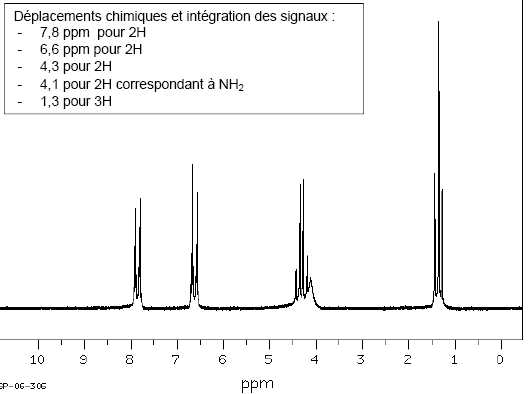 On retrouve les deux signaux caractéristiques du groupe éthyle CH2 - CH3.
Quadruplet ( 2H) vers 4,3 ppm et triplet ( 3H) vers 1,3 ppm.
|
|
|