La
vitamine C : la molécule, titrage. Bac
S Inde 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
La
vitamine C est commercialiser sous forme de comprimé à croquer. On
donne la composition d'un comprimé : acide ascorbique : 250 mg ;
ascorbate de sodium : 285 mg ; excipients : sucres, arômes artificiels.
L'acide ascorbique, de formule C6H8O6,
sera noté HA et sa base conjuguée A-. pKa(AH
/ A-) = 4,1 à 37°C ; M(AH) = 176,1 g/mol ;
M(ascorbate de sodium)=M(ANa) = 198,1 g/mol.
Conductivité molaire ionique à 25°C en mS m2 mol-1
:
l(Na+)
= 5,01 ; l(OH-)
= 19,9 ; l(A-)
= 3,42.
pH de l'estomac : 1,5 ; pH de la salive compris entre 5,5 et 6,1.
Etude
de la molécule.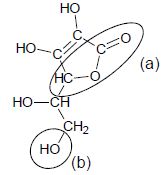
Nommer les familles associées aux groupes caractéristiques a et b.
a : famille des esters (
cycliques ) ; b : famille des alcools ( primaires).
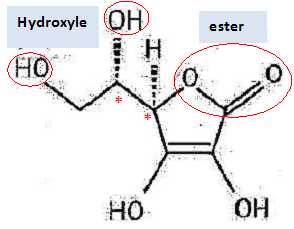
Repérer sur la molécule les atomes de carbone asymétriques en
justifiant.
Un atome de
carbone asymétrique est tétragonal et lié à 4 atomes ou groupes
d'atomes différents.
 Trois
stéréoisomères de la molécule d'acide ascorbique sont représentés
ci-dessous. Reconnaître si ces représentations sont identiques,
énantiomères ou diastéréoisomères.
Trois
stéréoisomères de la molécule d'acide ascorbique sont représentés
ci-dessous. Reconnaître si ces représentations sont identiques,
énantiomères ou diastéréoisomères.
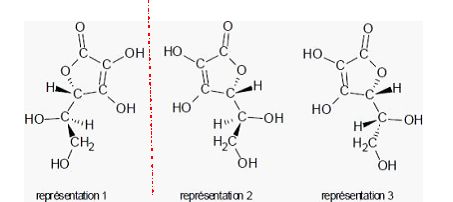
Enantiomères : représentations 1
et 2. ( symétrie par rapport à un miroir plan )
Diastéréoisomères
: représentations 2 et 3 et 1 et 3.
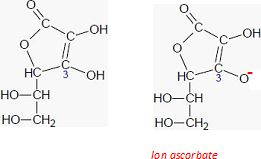
Les
propriétés acido-basiques de cette molécule sont dues à l'hydrogène
porté par l'oxygène du groupe caractéristique associé au carbone en
position 3. Représenter l'ion ascorbate.
|
| .
. |
|
|
Sous quelle forme
la substance active ingérée se trouve-t-elle sur la langue ? Dans
l'estomac ? Justifier.
Le pH de la
salive est supérieur à pKa : sur la langue la forme A- prédomine.
Le pH de
l'estomac est inférieur à pKa : dans l'estomac la forme AH
prédomine.
Vérification
de la masse d'acide ascorbique dans un comprimé.
On souhaite vérifier l'indication portée sur la boîte, concernant la
masse d'acide ascorbique présente dans un comprimé, à l'aide d'un
titrage acidobasique suivi par conductimétrie. Une solution aqueuse SA
de volume V = 200,0 mL est préparée à partir d'un comprimé entier. On
prélève un volume VA = (20,0 ±0,1) mL de cette
solution que l'on titre par une solution d'hydroxyde de sodium.
Rédiger le protocole de préparation de la solution SA.
Introduire le comprimé (
après
l'avoir peser à l'aide d'une balance de précision ) dans une fiole
jaugée de 200 mL contenant au 2/3 d'eau distillée ; agiter pour
dissoudre totalement le solide ; compléter jusqu'au trait de jauge avec
de l'eau distillée ; agiter pour rendre homogène.
Ecrire l'équation de la réaction support du titrage.
AH aq + HO-aq ---> A-aq + H2O(l).
|
.
|
|
Au
laboratoire on dispose d'une solution aqueuse étalonnée d'hydroxyde de
sodium de concentration cB = 0,100 mol/L. On
souhaite obtenir un volume VE à l'équivalence
proche de 10 mL. La solution d'hydroxyde de sodium convient-elle ?
Sinon que faut-il faire ?
Quantité de
matière d'acide ascorbique dans un comprimé : n = 0,250 176,1
=1,42 10-3 mol.
[AH] =1,42 10-3 / 0,200 =7,1 10-3 mol/L.
VE = [AH]VA / cB = 7,1 10-3 *20,0 / 0,100 = 1,4 mL.
Il faudra
diluer 8 fois la solution d'hydroxyde de sodium.
Parmi les 4 graphes uivants, lequel représente l'allure de l'évolution
de la conductivité s
du mélange ? Justifier.
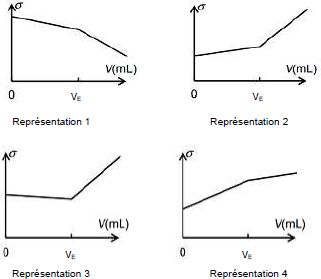
Du
point de vue de la conductivité
: avant l'équivalence, l'ion hydroxyde est en défaut ; tout
ce
passe comme ci on ajoutait des ions sodium et des ions ascorbate à la
solution. La conductivité croît.
Après
l'équivalence, HO- est en excès et sa
conductivité molaire ionique est grande. La conductivité augmente
fortement. La
représentation 2 convient.
Avec une solution aqueuse d'hydroxyde de sodium de concentration cB
=(1,50 ±0,02) 10-2 mol/L, VE
= (9,1±0,2) mL. On en déduit que la masse d'acide ascorbique du
comprimé est 245 mg.
Déterminer l'incertitude U(m exp) / mexp.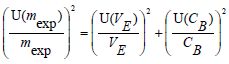
U(m exp) / mexp =[(0,2 / 9,1)2 +(0,02 / 1,50)2]½ =2,57 10-2~ 3 10-2.
Le résultat expérimental est-il en accord avec la mention portée sur la
boîte de comprimé ?
U(m exp) = 245 *2,57 10-2~6,3 mg.
Masse d'acide ascorbique dans le comprimé : (245 ±7 )mg. En accord avec
l'indication portée sur l'étiquette.
|
|
|
Vérification
de la masse d'ion ascorbate dans un comprimé.
Pour
vérifier par titrage la masse d'ascorbate de sodium contenue dans un
comprimé, que faut-il choisir comme réactif titrant ? Justifier.
A- une solution aqueuse d'hydroxyde de sodium.
B- Une solution aqueuse d'acide chlorhydrique.
C- Une solution aqueuse de chlorure de sodium.
L'ion ascorbate est une base faible. Le réactif titrant doit être un acide fort, comme l'acide chlorhydrique.
La
masse d'ascorbate de sodium trouvée après titrage correspond à celle
indiquée sur l'emballage. L'étiquette précise également que la masse
totale des deux espèces conjuguée est équivalente à 500 mg d'acide
ascorbique. Vérifier cette information par un calcul.
Acide ascorbique : 250 mg ;
ascorbate de sodium : 285 mg soit 0,285 / M(ANa) =0,285 /198,1 =1,44 10-3 mol.
Masse d'acide ascorbique équivalente : 1,44 10-3 *176,1 =0,253 g = 253 mg.
Total : 250 +256 = 503 mg.
Quel
intérêt présente cette formulation du comprimé de vitamine C par
rapport à un comprimé qui contiendrait uniquement 500 mg d'acide
ascorbique.
L'ascorbate de sodium est soluble dans l'eau ; l'acide ascorbique l'est beaucoup moins. La dissolution de ce comprimé dans l'eau sera plus commode.
Le comprimé constitue un milieu tamponé ( pH =4,1), moins agressif pour l'organisme que l'acide ascorbique.
|
|
|