Synthèse
de l'acide dichlorocyanurique ( ADCC). Olympiades chimie
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
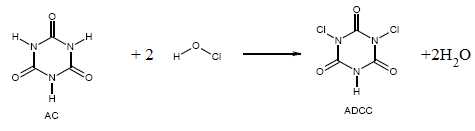
L’ADCC
s’obtient par chloration de l’acide cyanurique (AC). Lorsqu’on traite
l’AC par des quantités équimolaires d’hypochlorite et d’acide
chlorhydrique, on obtient l’ADCC suivant l’équation de la réaction
ci-dessous.
L’acide
hypochloreux (HClO) est fabriqué in-situ par ajout d’hypochlorite de
calcium et d’acide chlorhydrique dans des quantités équimolaires.
L’acide hypochloreux formé peut ensuite réagir avec l’acide cyanurique
(AC) pour former l’acide dichlorocyanurique (ADCC).
La réaction doit
se faire dans les limites strictes de pH : tout au long de la synthèse
le pH doit rester dans l’intervalle suivant : 2,8 < pH < 3,5. En
effet :
- en milieu plus acide (pH < 2,5), il y a formation de dichlore gazeux toxique Cl2 (g).
- à pH > 3,5, la réaction se fait plus difficilement et conduit à la formation de sous-produits.
Quelle est la formule de l'ion hypochlorite et celle de l'ion calcium ? En déduire la formule de l'hypochlorite de calcium.
ClO- ; Ca2+ ;Ca ( ClO)2.
Comment préparer une solution d'hypochlorite de calcium à 2 mol.L-1 en ions hypochlorite ?
L'hypochlorite de calcium est un solide blanc gris de masse molaire M =143 g/L.
Une solution d'hypochlorite de calcium à 1 mol/L contient 2 moles d'ion hypochlorite.
Peser m = 143 g d'hypochlorite de calcium et le dissoudre dans l'eau distillée en utilisant une fiole jaugée de 1,00 L.
Les ions hypochlorite réagissent avec l'eau suivant une réaction acido-basique : écrire cette réaction.
ClO-aq + H2O(l) = HClOaq +HO-aq.
Le pH de la solution d'hypochlorite de calcium vaut 11,5.
Que valent alors les concentrations en ions H3O+ et en ions HO– dans cette solution considérée à 25°C ?
[H3O+]=10-pH = 10-11,5 = 3,2 10-12 mol/L ; [HO-]=10-14 /[H3O+] =10-2,5 =3,2 10-3 mol/L.
Que vaut alors le rapport [HClO] / [ClO-] dans cette solution ? pKa(HClO / ClO-) = 7,53.
pH = pKa + log([ClO-]/[HClO]) ; log( [HClO] / [ClO-]) =pKa -pH = 7,53-11,5 = -3,97.
[HClO] / [ClO-] =1,1 10-4.
Pourquoi,
lors de la synthèse, a-t-on ajouté de l'acide chlorhydrique dans le
mélange réactionnel en même temps que l’hypochlorite de calcium ?
En milieu acide la forme acide HClO du couple acide base prédomine.Déterminer alors la valeur du rapport [HClO] / [ClO-] dans ce mélange réactionnel lorsque le pH vaut 3,0. log( [HClO] / [ClO-]) =pKa -pH = 7,53-3,0 = 4,53.
[HClO] / [ClO-] =3,4 104.
Justifier la nécessité de se placer à ce pH lors de la synthèse.
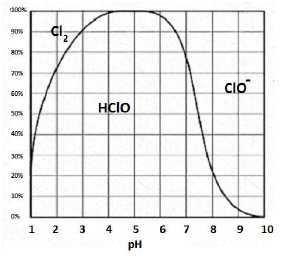
D'une part HClO doit prédominer ; d'autre part, il ne faut pas former de dichlore.
|
| .
. |
|
|
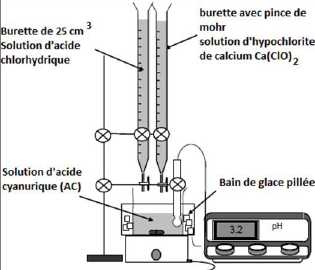
Dans
le bécher de 250 mL, introduire environ 45 mL d’eau et, tout en
agitant, ajouter exactement 3,00 g d’acide cyanurique. A l'aide d'une
burette ajouter un volume de 25 mL de solution d'hypochlorite de
calcium à 2,0 mol/L d'ion hypochlorite.
Quelle masse maximale mth d’ADCC peut-on théoriquement former lors de cette synthèse en supposant que cette réaction est totale ? M(AC) =129 g/mol ; M(ADCC) =198 g/mol.
Quantité de matière des réactifs :n(AC) =3,00 / 129 =2,3256 10-2 mol :
n(HClO) =2,0 *25 10-3 = 5,0 10-2 mol.
Or une mole d'AC réagit avec 2 mol d'HClO : HClO est donc en ecxès.
On peut espérer obtenir au plus 2,3256 10-2 mol d'ADCC soi tmth =2,3256 10-2 *198 =4,60 g.
Déterminer le rendement h de cette synthèse sachant qu'on a obtenu 3,5 g d'ADCC.
Rendement = masse expérimentale / masse théorique = 3,5 / 4,60 = 0,76 ( 76 %).
|
.
|
|
Quel
est le risque d'ajouter trop d'acide chlorhydrique au cours de la
synthèse ? Ecrire l'équation de la réaction correspondante.
Formation de dichlore si le milieu et trop acide.
Oxydation de l'ion chlorure : 2Cl- = Cl2 + 2e-.
Réduction de HClO : 2HClO + 2e- +2H3O+ = Cl2 + 4H2O.
Bilan : HClO + Cl- +H3O+ = Cl2 + 2H2O.
Pourquoi est-il important de travailler sous hotte ?
Le dichlore est un gaz toxique.
Test 1 : dans 2 tubes à essais, introduire 1 mL d'acide éthanoïque commercial.
- Ajouter dans chaque tube, 1 goutte d'hélianthine (indicateur coloré acido-basique).
-
Ajouter dans un des deux tubes, une pointe de spatule d’acide
cyanurique (AC) commercial, et dans le deuxième une pointe de spatule
d’acide dicholorocyanurique (ADCC) synthétisé, après l'avoir écrasé en
poudre très fine. Dans le tube n°2, on observe la disparition de la
couleur rouge.
Quel pouvoir à l'ADCC en milieu acide ?
Comme l'eau de Javel, l'ADCC a des propriétés décolorante en milieu acide.
Test 2 :
Dans 2 autres tubes à essais, introduire 1 mL d'acide éthanoïque commercial.
Ajouter :
- dans un des deux tubes, une pointe de spatule d’acide cyanurique (AC) commercial,
-
dans le deuxième une pointe de spatule d’acide dicholorocyanurique
(ADCC) synthétisé, après l'avoir écrasé en poudre très fine.
Dans chacun des 2 tubes, ajouter environ 2 mL d'une solution réductrice d'iodure de potassium à 0,5 mol.L-1.
On observe l'apparition d'une couleur brune dans le tube n°2.
Quel produit est responsable de la couleur obtenue ? Quelles sont les propriétés oxydantes et/ou réductrices des espèces AC et ADCC mises en jeu lors du test.
La couleur brune est due à la formation de diiode.
L'ADCC a des propriétés oxydantes en milieu acide : oxydation de l'ion iodure en diiode.
Pourquoi le pH de l'eau d'une piscine doit-il être compris entre 7 et 7,5 ?
pH < 7,5 : HClO prédomine ; ce dernier possède un pouvoir oxydant supérieur à l'ion hypochlorite.
Les chloramines irritantes qui se forment à partir des matières organiques sont détruites.
pH > 7 : une eau trop acide corrode les parois en ciment, irrite les yeux et les muqueuses, favorise l'apparition d'algues.
Les baigneurs associent souvent une forte odeur de chlore à une piscine « trop traitée ». Est-ce le cas ? Expliquer.
Les
chloramines ont une odeur de chlore. S'il n'y a pas suffisamment de
désinfectants pour oxyder les chloramines, celles-ci ne sont pas
entièrement détruites.
|
|
|