Dosage de l'alcool
dans le sang.
Concours technicien police technique et scientifique 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Dosage volumétrique ( méthode de Cordebard).
L'éthanol
peut être oxydé directement en acide éthanoïque par l'ion dichromate en
excès. L'excès d'ion dichromate est dosé par iodométrie.
Etude du pouvoir oxydant de l'ion dichromate en fonction du pH.
Déterminer le nombre d'oxydation ( no) de l'élément chrome dans les espèces suivantes :
Cr2O72- : 2 no +7(-2) = -2 ; no = VI ; Cr3+ : +III ; Cr(OH)3 solide : no +3(-2+1) =0 ; no =+III.
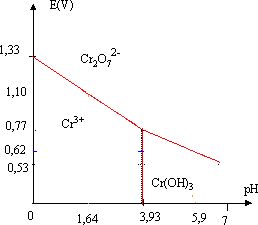
La concentration de chaque espèce dissoute en élément chrome est égale à 1 mol/L.
Déterminer le produit de solubilité de Cr(OH)3.
Cr(OH)3(s) = Cr3+aq + 3HO-aq ; Ks = [Cr3+][HO-]3.
Cr(OH)3(s) commence à précipiter à partir de pH = 3,93 soit [HO-] = 10-10,07 mol/L.
Ks = 1 *(10-10,07)3 ~6,1 10-31.
Déterminer le potentiel standard E°( Cr2O72- / Cr3+).
Cr2O72- +14H+ +6 e- = 2 Cr3++7H2O.
E = E°( Cr2O72- / Cr3+) +0,01 log ([Cr2O72-][H+]14/ [Cr3+]2).
A pH=0, pour [Cr2O72-]=[Cr3+] = 1 mol/L, E°( Cr2O72- / Cr3+) =1,33 V.
L'éthanol peut être oxydé en acide éthanoïque.
On souhaite tracer le diagramme potentiel -pH en solution
aqueuse relatif aux trois espèces
CH3-COOH,
CH3-COO-,
C2H5OH. A la frontière entre deux espèces
dissoutes, les concentrations des deux espèces sont
égales à 0,1 mol/L.
Quel sont les domaines de pH
à considérer ainsi que le couple Ox / red
correspondant à chacun des domaines ?
pH < 4,8 : CH3-COOH /
C2H5OH ; E°1 = 0,037 V
; CH3-COOH +4 H+ + 4e- =
C2H5OH + H2O.
pH > 4,8 :
CH3-COO- /
C2H5OH ;
CH3-COO- +5 H+ +
4e- = C2H5OH +
H2O.
Donner l'expression du potentiel
de chaque couple.
E1 = E°1 (CH3-COOH
/ C2H5OH) + 0,06/4 log
([CH3-COOH][H+]4
/ [C2H5OH])
E1 = 0,037 -0,06
pH (1)
E'1 = E°1
(CH3-COO- /
C2H5OH) + 0,06/4 log
([CH3-COO-][H+]5/
[C2H5OH] )
E'1 = E°1
(CH3-COO- /
C2H5OH) + 0,06/4 log
([CH3-COO-][H+]5
/ [C2H5OH] )
Constante d'acidité Ka =
[CH3-COO-][H+]
/ [CH3-COOH]
E1 = E°1 (CH3-COOH
/ C2H5OH) + 0,06/4 log
([CH3-COO-][H+]5
/ (Ka[C2H5OH])
E1 = E°1 (CH3-COOH
/ C2H5OH) + 0,06/4 log
(1/Ka) +0,06/4 log
([CH3-COO-][H+]5
/ [C2H5OH]))
On identifie : E°1
(CH3-COO- /
C2H5OH) à E°1
(CH3-COOH / C2H5OH) +
0,06/4 log (1/Ka)
E°1 (CH3-COO- /
C2H5OH) =E°1
(CH3-COOH / C2H5OH) +
0,06/4 log (1/Ka)
E°1 (CH3-COO- /
C2H5OH) =0,037 +0,06/4 *4,8 - 0,06 / 4
*14*5 =0,037+0,072 =0,109 V
E'1 = 0,109 + 0,06/4 log
([CH3-COO-][H+]5
/ [C2H5OH]) = 0,109
-0,06*5/4pH
E'1 =0,109 - 0,075
pH (1')
|
| .
. |
|
|
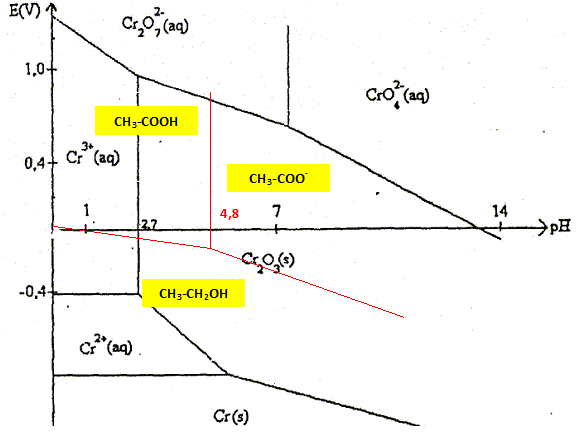
L'éthanol et l'ion dichromate sont dans
des domaines disjoints : en milieu acide, l'ion dichromate
peut oxyder l'éthanol en acide
éthanoïque.
|
.
|
|
Dosage de l'éthanol dans le sang par volumétrie.
L’éthanol
contenu dans10 mL de sang est séparé par distillation, en présence d’acide
picrique qui a une action défécatrice et antimousse. Le distillat est
recueilli dans une fiole jaugée de 50 mL contenant de l’eau distillée et
placée dans un bain réfrigérant. La solution aqueuse d’éthanol est
alors mise en présence d’une solution nitrochromique (mélange d’acide
nitrique et de dichromate de potassium) à froid et en excès. L’excès
d’ions dichromate est dosé en retour par iodométrie. Un essai à blanc
est pratiqué en parallèle par remplacement de la solution aqueuse
obtenue à partir du distillat par de l’eau distillée.
Mode opératoire :
Dans un erlenmeyer de 250 mL, on introduit 5 mL de distillat, 10 mL de solution acidifiée de dichromate de potassium à 1,8 10-2 mol/L.
On agite, on bouche et on laisse reposer pendant 10 minutes. Le
dichromate en excès est neutralisé en milieu acide par ajout de 10 mL
d'iodure de potassium à 10 % massique.
On dose le diiode formé par une solution de thiosulfate de sodium à 5,0 10-2 mol/L. Volume versé à l'équivalence VE = 19,75 mL.
Ecrire les trois équations d'oxydoréduction mises en jeu. Déterminer le
nombre de moles d'ion dichromate utilisées pour l'oxydation de
l'éthanol. Déterminer le titre d'éthanol dans le sang en g/L.
3 fois{ C2 H6
O +H2O= C2H4
O2 + 4 électrons + 4H+}.
2 fois{Cr2O72-
+ 6 electrons +14 H+
= 2 Cr3+ + 7 H2O}.
3 C2 H6 O + 2Cr2O72-
+28 H+ +3H2O---> 3
C2H4 O2
+ 4 Cr3+
+ 12 H+ + 14 H2O.
3 C2 H6 O + 2Cr2O72-
+16 H+ ---> 3 C2H4
O2 + 4 Cr3+ + 11
H2O. n(alcool) =1,5 n(Cr2O72-).
Cr2O72-
+ 6 e- +14 H+
= 2 Cr3+ + 7 H2O.
3 fois{2I-
= I2 +2e-}.
Cr2O72-
+ 6 I- +14 H+
= 2 Cr3+ +3I2 +7 H2O.
n (I2)=3 n(Cr2O72-)excès.
I2 +2e-= 2I-.
2S2O32- = S4O62- + 2e-.
I2 +2S2O32- = S4O62- +2I-. n(I2) =½n(S2O32-). Par suite : 3
n(Cr2O72-)excès =½n(S2O32-).
n(Cr2O72-)excès
=n(S2O32-) / 6 = 5,0 10-2 *19,75 /6= 0,1646 mmol.
n(Cr2O72-) oxydant
l'alcool =n(Cr2O72-) totale
- n(Cr2O72-)excès =1,8 10-2 *10 -0,1646 =0,0154 mmol.
n(alcool) = 1,5*0,0154 = 0,0231 mmol dans 5 mL de distillat soit 0,231 mmol d'éthanol dans 10 mL de sang.
0,231 / 10 = 0,0231 mol d'éthanol par litre de sang ou 0,0231 M(éthanol) = 0,0231*46=1,06 ~1,1 g/L. ( infraction).
|
|
|
La technique analytique est la GC/ FID. Que signifie ces acronymes anglais ?
Chromatographie gazeuse couplée à un détecteur à ionisation de flamme.
On
procède au dosage de l'éthanol par la méthode de l'étalonnage interne,
l'étalon étant l'isobutanol. Les conditions opératoire sont les
suivantes :
Colonne : Carbowax ( 30 m x 0,25 mm x 0,25µm).
Injecteur de type splitless. Gaz vecteur : hélium à 33 cm/s.
Températures : colonne 40°C pendant 4 min ; 40°C à 220°C à 15°C / min ; 220°C pendant 2 min.
Injecteur : 200°C ; détecteur 300°C.
On obtient le chromatogramme ci-dessous :
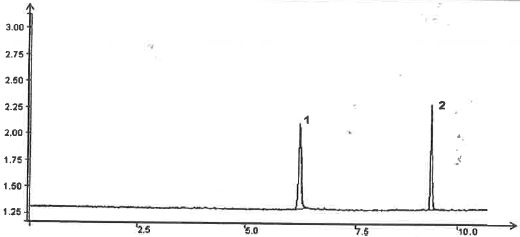
chromatogramme donne la variation de l'absorbance relative ( %) de l'éluant en fonction du temps ( min).
Qu'est ce que le mode d'injection "splitless" ? Quand l'utilise-t-on ?
L'injection est sans division :
l'échantillon est vaporisé et mélangé dans le gaz porteur ; le mélange
n'est pas divisé en deux parties. On utilise cette méthode quand l''échantillon à analyser est très dilué. Elle permet d'analyser des composés très volatils.
Quels seraient les gaz vecteurs que l'on pourrait utiliser pour remplacer l'hélium ?
Gaz inerte chimiquement vis à vis des substances à chromatographier, très purs : Argon, azote, hydrogène.
Expliquer en quoi consiste la méthode de l'étalon interne. Comment se fait le choix de l'étalon interne ?
L'aire
sous le pic est en général proportionnelle à la quantité de matière
injectée. Or le volume injecté est très faible et sa reproductibilité
est insuffisante pour obtenir des résultats précis.
La méthode de l'étalon interne rend les résultats indépendants du
volume injecté tant que l'on reste dans le domaine linéaire de réponse
du détecteur.
L'étalon doit être soluble dans l'échantillon ; il doit sortir sous
forme de pic isolé, proche du pic analysé ; l'introduction d'une
concentration connue de l'étalon ne doit pas perturber l'échantillon.
La concentration de l'étalon doit être du même ordre de grandeur que celle de l'espèce à doser.
|
|
|