Spectrométrie
d'absorption atomique et méthode des ajouts dosés.
Concours technicien police technique et scientifique 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
On
souhaite déterminer la concentration en cuivre dans un échantillon de
vin par spectrophotométrie d'absorption atomique à l'aide d'une flamme
air acéthyylène oxydante et d'une lampe à cathode creuse de cuivre ( l
= 324,7 nm) selon la méthode dite des ajouts dosés.
Décrire
la loi utilisée en spectrométrie d'absorption atomique qui relie la
valeur du signal à celle de la concentration de l'espèce à quantifier.
L'absorbance A de la solution suit une loi de type Beer-Lambert ( A = KCCu où A est l'absorbance, CCu
la concentration totale en élément cuivre, K un coefficient propre à
chaque élément pour la longueur d'onde choisie ). Cette loi n'est
valable que pour les concentrations faibles, typiquement inférieures à
3 ppm..
Lorsqu'une lumière monochromatique
d'intensité I0 ( candela) traverse un milieu
homogène, l'intensité de la lumière
émergente I décroît exponentiellement
lorsque l'épaisseur l du milieu absorbant
augmente.
I = I0 . e (-
al)
a est une constante appelée coefficient
d'absorption, caractéristique du milieu et de la
longueur d'onde considérés.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) ( A est
l'absorbance
ou densité
optique)
Calculer en fonction de I0 la valeur de l'intensité du faisceau après passage dans la flamma si A = 3. Quel risque prend-on lorsqu'on considère une telle mesure lors d'un étalonnage ? Quelle solution préconisez-vous alors ?
3 = log (I0/I) ; I = 10-3 I0.
L'intensité de la lumière
émergente est bien trop faible. Pour une meilleure précision,
l'absorbnace ne doit pas dépasser 1. Il faut diluer l'échantillon.
Thermochimie.
On s'intéresse à la zone de combustion primaire de la flamme, là où le
mélange air acéthylène s'effectue en proportions stoechiométriques. On
considère que l'air est constitué de 80 % de diazote et de
20 % de dioxygène. C'est le dard de la flamme qui correspond à la zone
blanche de la flamme. Les gaz entrent à 298 K dans la flamme sous
une pression de 1,0 bar et on admet que le système gazeux évolue de
manière adiabatique. L'équation de la réaction de combustion associée à
cette transformation est :
C2H2(g) + 2,5 O2(g) = 2 CO2(g) + H2O(g).
Calculer l'enthalpie standard de combustion de l'acéthylène.
DfH°(C2H2(g))=226 kJ/mol ; DfH°(CO2(g))= -393 kJ/mol ; DfH°(H2O)= -242 kJ/mol ;
DrH° =2 DfH°(CO2(g)) +DfH°(H2O) -DfH°(C2H2(g)) =-2*393-242-226 = -1254 kJ/mol.
Calculer la valeur de la température des gaz après combustion complète sous une pression de 1,0 bar.
avant combustion : C2H2(g) : n0 ;
O2(g): 2,5 n0 ;
N2(g): 10 n0 ;
après
combustion : H2O(g) : n0 ; N2(g): 10 n0 ; CO2(g): 2
n0.
L'énergie
dégagée par la combustion chauffe les
produits formés :
n0
DrH°
+ [2n0CP CO2 + 10 n0CP N2 +
n0CP H2O ]
(Tf-T0) =0
Tf-T0
= -DrH°
/ [2CP CO2 + 10 CP N2
+ CP H2O
]
Tf =
T0 - DrH°
/ [2CP CO2 + 10 CP N2
+ CP H2O
].
A.N : CP CO2 = 36,9 ; CP H2O = 36,2 ; CP N2 =29,3 J mol-1 K-1.
Tf = 298 + 1,254 106
/ [2*36,9 + 293+ 36,2] = 3,4 103 K.
Pourquoi peut-on faire l'hypothèse d'une transformation adiabatique ?
La combustion dans l’air est suffisamment rapide pour être
adiabatique.
|
| .
. |
|
|
Méthode des ajouts dosés.
Soit une solution étalon
S d'ion cuivre (II) à la concentration de 10 mg/L. Quelle masse m de
sulfate de cuivre pentahydraté faut-il dissoudre dans 1 L d'eau
ultra-pure ?
Quantité de matière d''ion cuivre II : n=0,010 / M(Cu) = 0,010 / 63,5 =1,5748 10-4 mol.
m = n M(sulfate de cuivre pentahydraté) = 1,5748 10-4 *249,6 =3,93 10-2 g~39 mg.
Donner la concentration de la solution S en ppm.
La densité d'un vin à 12° en volume est proche de 1.
Masse de un litre de vin ~1000 g= 1,0 106 mg.
39 mg correspondent à 39 ppm ( partie par million ).
Calculer la conductivité de l'eau ultra-pure puis sa résistivité.
L'eau ultra-pure contient des molécules d'eau et des ions hydroxyde et oxonium tels que [H3O+]=[HO-] = 10-7 mol/L = 10-4 mol m-3.
s =( lH3O+ +lHO-)10-4 =(34,98 10-3+19,86 10-3 )10-4 =5,484 10-6 S m-1.
Résistivité : 1/(5,484 10-6 )=1,82 105 W m.
|
.
|
|
Des
quantités connues de la solution S de cuivre (II) sont ajoutées à des
prélevements identiques de l'échantillon de vin. Chaque solution est
ensuite diluée jusqu'à un volume donné avant de mesurer en absorption
atomique son absorbance. Calculer pour chaque fiole les valeurs DC d'ajout de cuivre.
Fiole n°
|
0
|
1
|
2
|
3
|
4
|
Volume échantillon de vin ( mL)
|
10,00
|
Volume de solution S (mL)
|
0
|
1,00
|
2,00
|
3,00
|
4,00
|
Eau ultra-pure
|
Compléter la fiole jaugée à 50 mL
|
Absorbance
|
0,1
|
0,15
|
0,2
|
0,25
|
0,3
|
DC ( mg/L)
|
0
|
0,01 /0,050 = 0,2
|
0,4
|
0,6
|
0,8
|
Déterminer graphiquement la teneur en cuivre de l'échantillon et conclure.
Absorbance de la solution i : Ai = K CiE + b avec b =KCdvin où Cdvin est la concentration massique en élément cuivre du vin dans les fioles préparées.
A = KCCu où A est l'absorbance, CCu la concentration totale en élément cuivre
Ai = K
(Cdvin +CiE ) = KCiE + KCdvin.
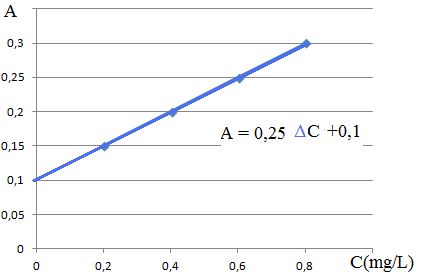
Cvin =0,10 / 0,25 = 0,40 mg/L.
Tenir compte de la dilution :
Cvin =0,40 *5 = 2,0 mg/L.
Cette valeur est supérieure à la concentration limite 1 mg/L. Le vin est non conforme.
Quel est l'intérêt de cette méthode par rapport à un étalonnage externe? Comment améliorer la précision du dosage ?
La méthode des ajouts
dosés est simple et ne nécessite que trois points d'analyse. La
précision des résultats ne dépend que de la concentration de la
solution étalon. Elle est très utilisée pour la détermination de traces
d'éléments chimiques.
La
précision serait meilleur si l'absorbance des solutions variaient entre
0,1 et 1. Tripler les volumes de la solution S ajoutés dans les
différentes fioles.
|
|
|