Autour du styrène.
Bac S Antilles 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Le
polystyrène et le polystyrène expansé sont des matériaux fréquemment
utilisés dans le domaine de l’isolation et de l’emballage. Ces
polymères sont synthétisés à partir d’une même molécule, le styrène. Le
styrène est disponible auprès des fournisseurs spécialisés sous la
forme d’un liquide commercialisé pur ou dilué dans un solvant
spécifique.
1. Obtention industrielle
du styrène.
Le styrène fut célébré par Raymond QUENEAU dans un poème en alexandrins
intitulé « le chant du styrène » dont un extrait est reproduit ci-dessous :
Le styrène est produit en grande quantité
À partir de l’éthylbenzène surchauffé.
Faut un catalyseur comme cela se nomme
Oxyde ou bien de zinc ou bien de magnésium.
La voie de synthèse du styrène, évoquée dans le poème, est la
déshydrogénation de l’éthylbenzène, produit issu de la pétrochimie. Cette transformation
peut être modélisée par la
réaction d’équation suivante :
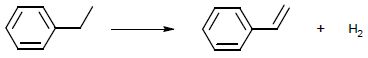
1.1. Cette réaction correspond-elle à une modification de chaîne ou à une modification de groupe
caractéristique ?
Le squellete carboné subit une modification : une liaison double CH=CH2 remplace une liaison simple CH2-CH3. La structure de la chaine est modifiée sans changer le nombre d'atome de carbone.
1.2. Parmi les trois grandes catégories de réactions en chimie organique, déterminer à quelle
catégorie appartient cette réaction.
Une petite molécule de dihydrogène est éliminée : réaction d'élimination.
1.3. Le poème indique que cette transformation chimique nécessite l’emploi de catalyseurs. Définir un catalyseur.
Un catalyseur accélélère une réaction thermodynamiquement possible. Il
n'apparaît pas dans le bilan. La composition finale du milieu
réactionnel n'est pas modifiée. Lorsque deux issues sont possibles, il
peut orienter la réaction.
1.4. Dans le cas de la synthèse du styrène, déterminer si la catalyse est homogène, hétérogène
ou enzymatique.
Le catalyseur est un solide, l'éthylbenzène est liquide : la catalyse est hétérogène.
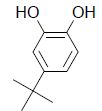
2. Préparation du styrène avant utilisation au laboratoire.
Le styrène, sensible à la lumière et aux températures élevées, peut se
polymériser dans la bouteille en l’absence de précaution. Pour éviter
cela, la solution de styrène est « stabilisée » par ajout d’un
inhibiteur de polymérisation : le 4-tert-butylpyrocatéchol de formule
topologique suivante :
Avant utilisation, il est donc nécessaire d’éliminer l’inhibiteur de
polymérisation. Pour cela, le protocole suivant est mis en oeuvre :
Sous une hotte ventilée, dans une ampoule à décanter, verser 10
mL du produit commercial à purifier contenant le styrène et le
4-tert-butylpyrocatéchol.
Ajouter 10 mL de solution d’hydroxyde de sodium (Na+ (aq) + HO-(aq)) de concentration molaire
1,0 mol.L-1.
Boucher, agiter l’ampoule, dégazer puis laisser décanter.
Observer les changements de couleur des deux phases. Éliminer la phase aqueuse.
Laver la phase organique recueillie avec 20 mL d’eau.
Récupérer la phase aqueuse dans un bécher et mesurer son pH.
Recommencer le lavage à l’eau jusqu’à obtention d’un pH proche de la
neutralité.
Placer le styrène extrait dans un erlenmeyer et ajouter une spatule de chlorure de calcium anhydre.
Filtrer le mélange et récupérer le styrène purifié.
|
|
|
2.1. Réalisation du protocole.
2.1.1. Les consignes de sécurité indiquées pour mettre en oeuvre ce protocole vous paraissent-elles justifiées ?
Oui, le styrène est cancérogène, dangereux pour la santé et inflammable.
2.1.2. Proposer d’autres précautions à prendre afin de manipuler en toute sécurité.
Travailler loin de toute flamme. Port de blouse, lunette et gants de sécurité.
2.2. Identifier les groupes caractéristiques présents dans la molécule de 4-tert-butylpyrocatéchol.
Deux groupes hydroxy OH sont présents. On retrouve également le cycle benzénique.
2.3. Déterminer la polarisation de la liaison O-H. Justifier que l’on trouve dans les tables de
données deux pKA, respectivement 9 et 13, pour le 4-tert-butylpyrocatéchol.
L'atome d'oxygène est plus électronégatif que l'atome d'hydrogène.
L'atome d'oxygène porte une charge partielle négative. L'atome
d'hydrogène des groupes OH est acide, l'anion résultant est stabilisé
par répartition de sa charge sur l'ensemble du cycle benzénique.
Le
4-tert-butylpyrocatéchol possède deux atomes d'hydrogène susceptibles
d'être libérés, cest un diacide faible, d'où l'existence de deux pKa.
2.4. Écrire les deux couples acide-base issus du diacide en notant H2A le 4-tertbutylpyrocatéchol.
Établir un diagramme de prédominance faisant intervenir les deux couples.
H2A / HA- et HA- / A2-.
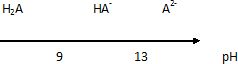
2.5. Estimer la valeur du pH de la solution d’hydroxyde de sodium utilisée pour le lavage.
Pour une base forte de concentrration 1 mol/L, le pH est voisin de 14.
2.6. Écrire l’équation de réaction mise en jeu entre le 4-tert-butylpyrocatéchol noté H2A et les ions
hydroxyde HO-, si les ions hydroxyde sont en large excès.
H2A +2HO-aq = A2-aq + 2H2O(l)
2.7. Expliquer pourquoi le lavage par la solution d’hydroxyde de sodium du produit commercial
contenant le styrène permet d’éliminer le 4-tert-butylpyrocatéchol.
Le 4-tert-butylpyrocatéchol est sous forme d'anion A2-, soluble dans l'eau, solvant polaire, insoluble dans le styrène.
2.8.
En schématisant l’ampoule à décanter, indiquer dans quelle phase se
trouve le styrène et dans quelle phase se situe le
4-tert-butylpyrocatéchol.
La phase aqueuse la plus dense occupe la partie inférieure ; la phase
organique ( le styrène densité 0,906 ) occupe la partie supérieure.
2.9. Expliquer le rôle des lavages supplémentaires à l’eau et du contrôle du pH.
Les lavages supplémentaires éliminent l'excès de soude.
2.10. Expliciter le rôle du chlorure de calcium anhydre
Le chlorure de calcium élimine les traces d'eau présentes dans le styrène..
|
|
|
|
3. Contrôle de la teneur en styrène dans le flacon commercial.
Le produit commercial utilisé indique que le pourcentage massique de
styrène est de 42 %. Toutefois, compte tenu des difficultés qui peuvent
être rencontrées lors de la conservation du styrène, il est recommandé
de déterminer sa concentration avant de l’utiliser. On réalise pour
cela une mesure d’absorbance du styrène à l’aide d’un spectrophotométre
UV-visible et on exploite cette mesure à l’aide d’un graphe fourni par
le fabricant.
Spectre d’absorption du styrène :
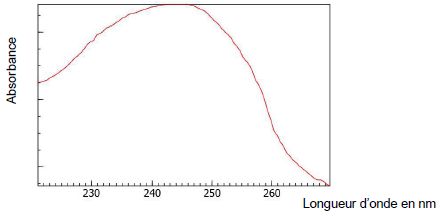
3.1. À quelle
longueur d’onde la mesure d’absorbance devra-t-elle être réalisée ?
Dans quel domaine les ondes correspondantes appartiennent-elles ?
Le maximum d'absorption se situe vers 250 nm, c'est à dire dans le domaine UV.
3.2. D’après le
graphe suivant fourni par le fabricant, quelle relation peut-on écrire
entre l’absorbance A de la solution et sa concentration C en styrène ?
À quelle loi empirique cette relation fait-elle référence ?
Graphe fourni par le fabricant du produit étudié :
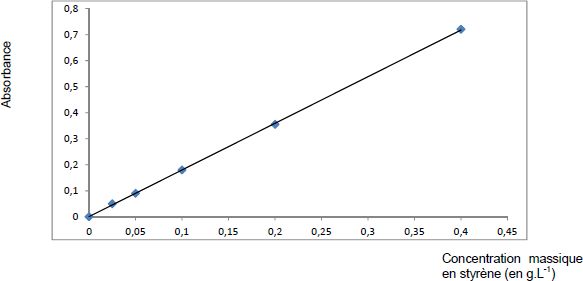
Loi de Beer- Lambert : la concentration et l'absorbance sont proportionnelles.
3.3. Proposer un protocole détaillé permettant d’obtenir précisément le graphe A = f(C) fourni par le fabricant du produit.
Réaliser une gamme étalon :
Dilution d'une solution mère de styrène de concentration connue c.
Solution filles de concentration 0,05 ; 0,1 ; 0,2 et 0,4 g/L en styrène ( fioles jaugées de 50,0 mL).
Mesure de l'absorbance en réglant le spectrophotomètre à 250 nm.
Faire le blanc en utilisant uniquement le solvant.
3.4. On prélève
alors une masse m = 10 mg de résine dans le flacon du produit
commercial étudié. Puis, dans le même solvant que celui utilisé pour
obtenir le graphe, on dissout ce prélèvement pour former une solution
de volume 50,0 mL. La mesure de l’absorbance de l’échantillon obtenu
conduit à une valeur de 0,15. Déterminer si le styrène s’est bien
conservé.
Concentration massique en styrène : 0,08 g/L d'après le graphe.
soit 0,08 *50 /1000 = 4 10-3 g ou 4 mg de styrène dans 10 mg de résine ( 40 % de styrène ).
En accord avec l'étiquette qui indique 42 %.
|
|