Du jus de pomme au
vinaigre. Bac S Polynésie 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Le vinaigre de cidre est obtenu par
double fermentation de jus de pomme, la fermentation alcoolique et la
fermentation acétique.
La fermentation alcoolique est due à l’oxydation du glucose contenu
dans le jus de pomme en présence de levures. Il se forme de l’éthanol
et du dioxyde de carbone. On obtient du cidre.
La principale transformation du cidre en vinaigre est due à des
micro-organismes, Mycoderma acetii, qui fixent les molécules de
dioxygène sur l’éthanol, ce qui conduit à la formation d’acide
acétique. 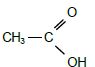 Cette transformation est appelée fermentation acétique. Cette transformation est appelée fermentation acétique.
1. Fermentation alcoolique.
Le glucose linéaire se trouve sous deux formes énantiomères, le D-glucose et le L-glucose.
Lors de la fermentation alcoolique, seul le D-glucose majoritairement
présent dans la nature se transforme sous l'effet de la zymase, une
enzyme produite par des levures.
La représentation de Cram de la molécule de D-glucose est donnée ci-dessous.
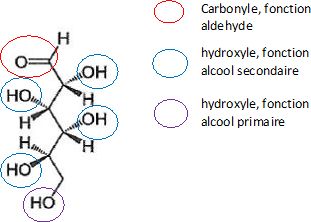 1.1. Établir l’équation de la réaction de fermentation alcoolique du D-glucose.
1.1. Établir l’équation de la réaction de fermentation alcoolique du D-glucose.
Pourquoi cette fermentation est-elle qualifiée de fermentation alcoolique ?
C6H12O6 +O2 --> 2C2H5OH + 2CO2.
L'un des produit formé est l'éthanol, un alcool, d'où le nom de fermentation alcoolique.
1.2. Quel est le rôle de la zymase dans la fermentation alcoolique ?
C'est un catalyseur, il accélère la réaction et n'apparaît pas dans le bilan.
2. Fermentation acétique.
2.1. Donner le nom en nomenclature systématique de l’acide acétique.
Acide éthanoïque.
2.2. Écrire la réaction de fermentation acétique due aux Mycoderma acetii en identifiant les deux produits formés. Montrer que
l’éthanol subit une oxydation lors de la fermentation acétique et en
déduire les couples oxydant/réducteur mis en jeu dans cette réaction.
Oxydation de l'alcool réducteur ( il cède des électrons) : CH3COOH / C2H5OH
C2H5OH +H2O= CH3COOH +4H+ +4e- .
Réduction du dioxygène, l'oxydant, il gagne des électrons : O2 / H2O.
O2 + 4H+ +4e- --> 2H2O.
C2H5OH + O2 --> CH3COOH + H2O.
Il se forme de l'acide éthanoïque et de l'eau.
|
|
|
3. Analyse d’un cidre en cours de fermentation.
La teneur acétique d’un vinaigre, exprimée en degré acétimétrique, est
égale à son acidité totale mesurée à 20 °C et exprimée en gramme
d'acide acétique pour 100 mL de vinaigre.
La teneur acétique minimale des vinaigres est de 5,0 g d'acide acétique
pour 100 mL de vinaigre. Néanmoins une différence de 0,2 degré, soit
deux grammes d'acide acétique par litre de vinaigre, peut être admise
en moins dans la mesure de cette teneur.
D’après « Décret n°88-1207 du 30 décembre 1988, modifié par n°2005-553 du 19 mai 2005 »
Un échantillon de cidre mis à fermenter est prélevé pour vérifier sa teneur acétique.
Un volume prélevé V = (25,0 ± 0,1) mL de l’échantillon de cidre dilué
dix fois est titré par une solution d’hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration molaire
c = (0,15 ± 0,005) moL.L-1.
Le suivi pH-métrique du titrage du cidre au cours de sa fermentation
conduit au graphe représenté ci-dessous et donnant l’évolution du pH du
milieu réactionnel et de sa dérivée en fonction du volume VB de solution d’hydroxyde de sodium versé.
|
|
|
|
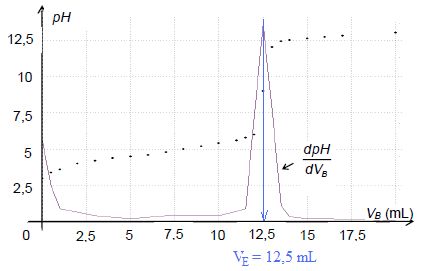
Déterminer
si le cidre mis en fermentation depuis plusieurs semaines et analysé
ci-dessus peut être commercialisé sous l’appellation vinaigre.
Quantité de matière d'acide éthanoïque dans la prise :
n = c VE = 0,15*12,5 = 1,875 mmol dans V = 25,0 mL.
Concentration en acide acétique : 1,875 / 25,0 = 0,075 mol/L
Tenir compte de la dilution : 0,75 mol/L
Masse d'acide acétique par litre de vinaigre : 0,75 *M(ac. acétique) = 0,75 *60 = 45 g
Soit 4,5 g d'acide acétique pour 100 mL de vinaigre.
Incertitude :
[U(d) / d]2 = [U(V) / V]2 +[U(VE) / VE]2 +[U(c) / c]2 ;
[U(d) / d]2 = [0,1 / 25]2 +[0,1 / 12,5]2 +[0,005 / 0,15]2 = 1,2 10-3.
[U(d) / d] = 3,5 10-2 ; U(d) = 3,5 10-2 *4,5 = 0,16 ~0,2 degré.
d = 4,5 ±0,2 degrés.
Cette valeur reste inférieure à la teneur minimale 5 -0,2 = 4,8.
Le décret n'est pas respecté.
|
|