Vitesse et
sécurité, alcoolémie, radiographie, acide aminés, ester.
Bac St2S Polynésie 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Exercice
1 :alcool, vitesse et sécurité.
1. Vitesse et sécurité routière.
1.1. Indiquer
l'unité dans le système international de chacune des grandeurs
intervenant dans la relation définissant l’énergie cinétique..
Ec = ½mv2.
Ec énergie en joule ; m : masse en kg ; v : vitesse en m s-1.
1.2. Montrer que la vitesse v = 90 km / h de la voiture avant le choc vaut 25 m.s-1.
90 / 3,6 = 25 m / s.
1.3. Calculer l'énergie cinétique de la voiture, contenant un chauffeur et un passager, avant le choc.
m = 1280 kg ; Ec = 0,5 *1280 *252=4,0 105 J.
Après l’arrêt brutal de ce véhicule contre un obstacle, on peut
comparer les dégâts à ceux liés à une chute libre verticale depuis une
hauteur h.
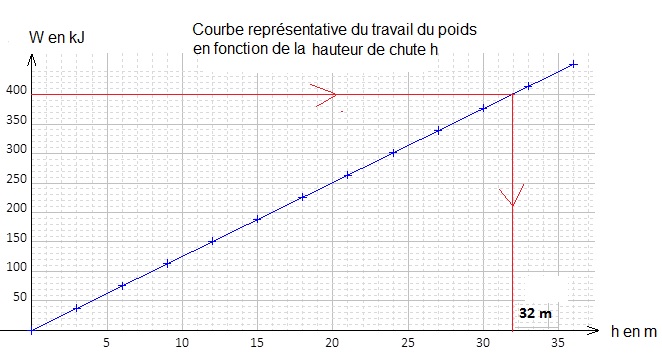
1.4. On suppose que l'énergie cinétique de la voiture avant le choc est de 400 kJ.
Déterminer graphiquement la hauteur de chute h qui engendrerait les mêmes dégâts que ceux observés lors de cet accident.
1.5.
La hauteur moyenne d’un étage est d’environ 3 mètres. Indiquer si la
phrase soulignée dans le document 1 est cohérente avec le résultat
trouvé à la question précédente. Justifier la réponse.
32 / 3 ~11 étages.
Cela n'est pas cohérent avec le texte "le choc équivaut à une chute de la voiture de 6 étages".
1.6. Lors de cet accident, le temps de réaction du conducteur a été modifié à cause de l’alcool.
Citer deux autres facteurs ayant une influence sur le temps de réaction.
La fatigue, la prise de drogues, l'alcool.
1.7. Lors de cet
accident, la distance de freinage a été augmentée en raison de la
vitesse excessive du véhicule. Citer deux autres facteurs ayant une
influence sur la distance de freinage
L'état de la route et l'état des pneus du véhicule.
2. l'alcoolémie du conducteur .
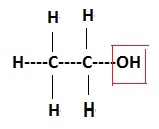
2.1. La formule brute de l'éthanol est C2H6O.
Ecrire la formule développée de l'éthanol et entourer le groupe alcool.
2.2. Les couples redox mis en jeu lors de la réaction d’oxydo-réduction dans l'éthylotest sont Cr2O72- /Cr 3+ et C2H4O/ C2H6O
2.2.1. Donner la définition d'un oxydant.
Un oxydant est une espèce susceptible de gagner un ou plusieurs électrons.
2.2.2. Indiquer si l'éthanol est oxydant ou réducteur lors de la réaction. Justifier la réponse.
L'éthanol est un réducteur qui s'oxyde : il cède des électrons.
C2H6O= C2H4O + 2H+ + 2e-.
2.2.3.
Ecrire l'équation de la réaction d'oxydoréduction entre les ions
dichromate et l'éthanol en utilisant les demi-équations (1) et
(2)données.
Cr2O72- +6e- + 14H+=2Cr 3+ +7H2O.
3C2H6O= 3C2H4O + 6H+ + 6e-.
Ajouter et simplifier.
3C2H6O+ Cr2O72-+ 8H+= 3C2H4O +2Cr 3+ +7H2O.
2.3. Déterminer, à partir des documents 1 et 4, le taux d'alcool (en g.L-1) dans le sang du conducteur.
Le conducteur a un taux de 0,75 milligramme d’alcool par litre d'air expiré.
0,5 gramme par litre de sang correspond à un taux d'alcool égal à 0,25 milligramme par litre d'air expiré.
Le conducteur a un taux de 1,5 g d'alcool par litre de sang.
2.4. Préciser si le conducteur était en capacité de conduire au moment de l'accident. Justifier la réponse à partir des documents.
1,5 g / L est supérieur à 0,8 g/L, donc incapacité totale à la conduite.
|
|
|
Exercice 2 : Prise en charge médicale du passager.
1. Examen radiographique.
Arrivé à l’hôpital, le passager du véhicule est pris en charge par le
service Imagerie médicale afin de procéder à une radiographie de ses
membres inférieurs sévèrement touchés lors du choc. Les jambes sont
alors exposées à un rayonnement électromagnétique délivré par un
générateur de rayons X portable.
1.1. Déterminer en mètre puis en nanomètre la longueur d'onde l des photons d’énergie E égale à 5,4 × 10-15 J, associés au rayonnement X utilisé lors de cet examen.
E = h c / l ; l = hc / E =6,63 10-34 *3,00 108 / (5,4 10-15)=3,68 10-11 m ~3,7 10-11 m.
3,7 10-2 nm ( 0,037 nm) .
1.2. Déterminer à partir du document 9 le type de rayons X utilisés lors de cet examen.
0,037 nm est compris entre 0,02 nm et 1,2 nm : rayons X intermédiaires.
1.3. Citer un moyen de protection contre les rayons X utilisé dans les cabinets de radiologie.
Ecran de plomb.
2. Perfusion d'acides aminés.
Afin de favoriser la guérison du patient, le médecin décide de lui
prescrire une perfusion d'AMINOPLASMAL 8. La solution perfusée par voie
intraveineuse permet d'apporter les acides aminés nécessaires à la
croissance, au maintien et à la régénération des tissus corporels
endommagés. Les acides aminés sont d'une importance particulière
puisqu'ils sont directement impliqués dans la synthèse des protéines.
2.1. A propos de la leucine.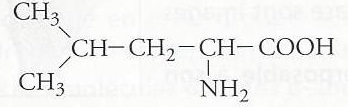
2.1.1. Déterminer la formule brute de la molécule de leucine.
C6H13NO2.
2.1.2. Montrer que la masse molaire M (leucine) de la molécule de Leucine vaut 131,0 g.mol-1.
M = 6*12 +13+14+2*16=131 g/mol
2.1.3.
Sachant qu’un flacon d’AMINOPLASMAL 8 contient 2,23 g de leucine,
calculer la quantité de matière de leucine présente dans un flacon.
n = m / M = 2,23 / 131 =1,70 10-2 mol.
2.1.4. En utilisant
la réponse à la question précédente, calculer la concentration molaire
C de la leucine dans la solution d’AMINOPLASMAL 8. Volume de perfusion
V= 500 mL.
C = n / V = 1,70 10-2 / 0,500 =3,40 10-2 mol / L ou 34 mmol/L
2.1.5. Préciser si l'indication"34 mmol / L" portée sur la notice est correcte. Justifier la réponse.
L'indication est correcte.
|
|
|
|
2.2. A propos de l'alanine.
2.2.1. Recopier sur la copie la formule semi-développée de la molécule d'alanine.
Encadrer et nommer les deux groupes caractéristiques présents dans cette molécule.
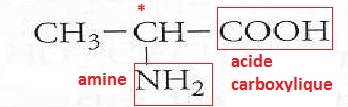
Groupe carboxyle : fonction acide carboxylique.
2.2.2. Donner la
définition d'un carbone asymétrique. Repérer par un astérisque ( * ) le
carbone asymétrique de la molécule d'alanine.
Atome de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
2.2.3. Donner la représentation de Fischer de la D-alanine.
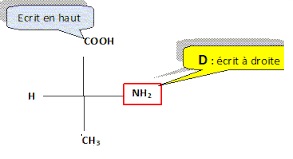
2.3. A propos de la dose quotidienne et de la vitesse de perfusion.
Le patient a une masse corporelle de 75 kg.
2.3.1. Calculer, en mL, le volume quotidien Vquot d'AMINOPLASMAL 8 transfusé à ce patient.
Dose quotidienne : 30 mL/kg de masse corporelle.
Vquot=30*75~2,3 103 mL ~ 2,3 L.
2.3.2. Calculer en mL.h-1 le débit maximal D de la perfusion pour ce patient.
Vitesse maximale de perfusion : 2 mL par kilogramme de masse corporelle et par heure.
D=2*75=150 mLh-1.
2.3.3. Calculer la durée minimale de la perfusion pour administrer la dose quotidienne d'AMINOPLASMAL.
Préciser si cette durée dépend de la masse corporelle du patient.
t = Vquot / D =30*75 / (2*75) = 30 / 2 = 15 h, indépendante de la masse du patient.
Exercice 3. synthèse de la benzocaïne.
La benzocaïne se prépare par réaction d'esterification entre l'acide 4-aminobenzoïque ( noté A) et un alcool B.
1.1. Entourer le groupe caractéristique ester. Ecrire la formule de l'alcool B et le nommer.
1.2. Donner deux caractéristiques de la réaction d'estérification.
Lente et limitée par l'hydrolyse de l'ester.
|
2.1. Citer deux précautions à prendre lors de la manipulation de l'acide sulfurique.
Il provoque de brûlures de la peau et provoque des lésions oculaires graves : port de gants et lunettes de sécurité.
2.2. Choisir le montage utilisé pour cette synthèse.
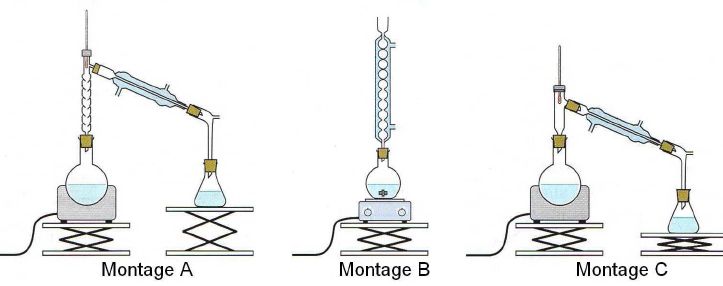
Montage B, chauffage à reflux.
3.1. Montrer que la quantité de matière de A initiale est nA = 2,2 10-2 mol.
MA = 137,0 g/mol ; mA = 3,0 g ; nA = mA / MA = 3,0 / 137 = 0,0219 ~2,2 10-2 mol.
3.2.Déterminer la quantité de matière de benzocaïne, notée ntotale, que l'on peut obtenir si la réaction était totale et l'alcool en excès.
0,0219 mol de A conduit à 0,0219 mol de benzocaïne si la réaction est totale et l'alcool en escès.
ntotale = 2,2 10-2 mol.
3.3.Montrer que la masse de benzocaïne est égale à 3,6 g si la réaction est totale et l'alcool en excès.
M(benzocaïne) = 165,0 g/mol.
mtotale = ntotale M(benzocaïne) = 0,0219*165 ~3,6 g.
3.4. La masse expérimentale est mexp = 1,7 g. Calculer le rendement de la synthèse.
mexp / mtotale=1,7 / 3,6 =0,47 ( 47 %).
|
|