QCM
chimie.
Concours kiné EFOM 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice 1.
L'aspartame
est un édulcorant artficiel présent dans le soda (S). Son pouvoir
sucrant est environ 200 fois supérieur à celui du saccharose. La dose
maximale admissible en aspartame est fixée à 40 mg par kilogramme
de masse corporelle par jour. Cette molécule est un dipeptide obtenu
par formation d'une liaison peptidique entre deux acides aminés.
Teneur en aspartame du soda : t = 0,50 mg /L.
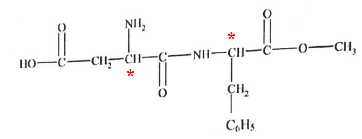
A. L'aspartame possède entre autre une fonction amine. Vrai.
B. Il existe 4 stéréoisomères de configuration de l'aspartame. Vrai.
L'existence de deux atomes de carbone asymétriques conduit à 4 stéréoisomères.
C. Il existe un unique couple d'énantiomères de l'aspartame. Faux.
D. Un adolescent de 50 kg pourrait boire jusq'à 1000 L de soda par jour sans dépasser la dose maximale admissible. Faux.
50*40 =2 000 mg par jour soit boire : 2000 / 0,50 = 4000 L par jour.
Exercice 2.
Le vert de bromocrésol est un indicateur coloré de pH dont les
formes acide et base conjuguées ont des couleurs différentes en
solution aqueuse. Laforme acide, notée HIn est de couleur jaune en
solution aqueuse alors que la teinte sensible prise par
l'indicateur coloré entre pH=3,8 et pH = 5,4 est verte. Une étude
expérimentale menée à 25°C permet de tracer la courbe p(HIn) = f(pH)
donnée ci-après. Elle représente l'évolution du pourcentage molaire de
la forme acide de l'indicateur coloré en fonction du pH de la solution
aqueuse dans laquelle elle se trouve.
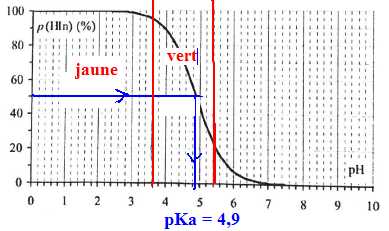
A. A 25°C, une solution de pH=6,0 est acide. Vrai.
B. A 25°C, le pKa du couple HIn / In- du vert de bromocrésol est de 4,9. Vrai.
C. A pH = 6 et à 25°C, une solution contenant comme unique indicateur coloré le vert de bromocrésol est jaune.
Faux.
D. La forme basique In- du vert de bromocrésol est bleue en solution aqueuse. Vrai.
Exercice 3.
On réalise le titrage par suivi pHmétrique d'un volume V =20,0 mL d'une solution aqueuse (S) d'éthanamine C2H5-NH2 par l'acide chlorhydrique de concentration molaire c = 1,0 10-2 mol/L. On donne la courbe obtenue. Couple C2H5-NH3+ / C2H5-NH2 : pKa = 10,7 à 25°C.
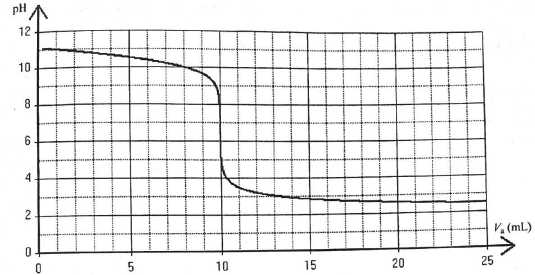
A. Le pH de la solution titrante est 2,5. Faux.
pH = -log c = -log 0,010 = 2.
B. Avant l'ajout d'acide chlorhydrique, la solution (S) à titrer contient déja des ions éthylammonium C2H5-NH3+ aq . Vrai.
pH = pKa + log( [C2H5-NH2 aq] /[C2H5-NH3+ aq]) ;
log( [C2H5-NH2 aq] /[C2H5-NH3+ aq]) = 11-10,7 = 0,3 ; [C2H5-NH2 aq] /[C2H5-NH3+ aq] ~ 2
[C2H5-NH3+ aq] = 0,5 [C2H5-NH2 aq].
C. Tant que le mélange est basique, c'est l'éthanamine qui prédomine devant l'ion étylammonium. Faux.
Tant que le pH du mélange est supérieur à pKa =10,7, c'est l'éthanamine qui prédomine devant l'ion étylammonium.
D. La concentration molaire en éthanamine apportée est c' = 5,0 10-3 mol/L. Vrai.
A l'équivalence cVE = c' V ; VE = 10 mL.
c' = cVE / V = 1,00 10-2 *10 / 20 = 5,0 10-3 mol/L.
Exercice
4.
La
pezmière étape du mécanisme de la réaction de saponification d'un
ester fait intervenir un ion hydrosyde. L'équation associée s'écrit :
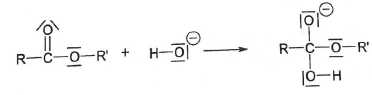
A. Il s'agit d'une étape correspondant à une réaction d'addition. Vrai.
B.
L'atome d'oxygène de l'ion hydroxyde est un site donneur de doublet d'électrons ( site nucléophile ). Vrai.
C. Dans la molécule d'ester, le site nucléophile mis en jeu est l'atome de carbone explicitement représenté. Faux.
... le site électrophile mis en jeu est l'atome de carbone explicitement représenté.
D. Si le groupe R' se réduit à un atome d'hydrogène, cette étape est une réaction acido-basique. Faux.
|
|
|
Exercice 5.
Le formiate d'éthyle est un ester utilisé comme solvant pour dissoudre
le nitrate de cellulose, l'acétate de cellulose et différentes résines.
Il est également utilisé comme arôme pour des saveurs fruitées. On
donne la formule topologique du formiate d'éthyle.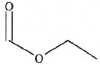
A. Cette molécule possède le groupe caractéristique carbonyle. Faux, groupe ester.
B. Le formiate d'éthyle se nomme le méthanoate d'éthyle en nomenclature officielle. Vrai.
C. La formule brute du formiate d'éthyle est C3H5O2. Faux, C3H6O2.
D. Aucun des trois spectres RMN du proton ci-après ne peut être celui du formiate d'éthyle. Faux.
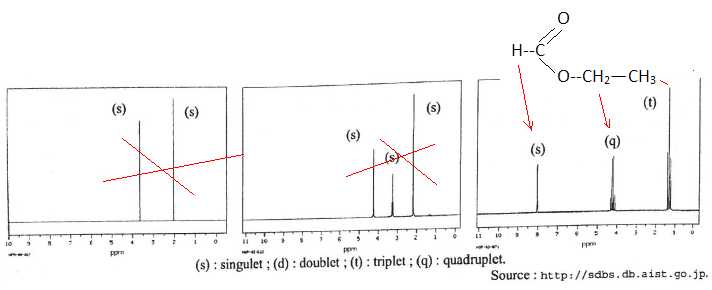
Exercice 6.
On étudie la transformation chimique modélisée par : :
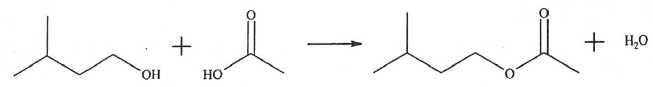
On
introduit 30 mL d'acide carboxylique liquide pur et 30 mL d'alcool
liquide pur. A l'issue de cette synthèse on recueille, en plus de
l'eau, une masse m(ester) = 13 g d'ester liquide pur
M(alcool) =
88 g/mol ; M(acide) = 60 g/mol ; M(ester) = 130 g/mol ; densité des
liquides : d(alcool) = 0,80 ; d(acide) = 1,0. Aide : 24 / 60 =0,40 ; 24
/ 881260,27 ; 30 / 88 ~0,34.
A. L'alcool utilisé est le 2-méthylbutan-1-ol. Faux, 3-méthylbutan-1-ol.
B. Le mélange initial contien 0,27 mol d'alcool. Vrai.
m(alcool) =30 *0,80 = 24 g ; n(alcool) = 24 / 88 ~0,27 mol.
C. L'acide carboxylique a été introduit en excès. Vrai.
m(acide) = 30 g ; n(acide) = 30 / 60 = 0,50 mol.
0,27 mol d'alcool réagit avec 0,27 mol d'acide en donnant au mieux 0,27 mol d'ester.
D. Le rendement de cette synthèse est 50%. Faux.
Quantité de matière réelle d'ester : 13 /130 =0,10 mol
Rendement : 0,10 / 0,27 ~0,37 ( 37 %).
|
|
|
|
Exercice 7.
La
(S)-carvone est une espèce chimique que l'on trouve en quantité notable
dans l'aneth et les gaines de carvi, d'où dérive son nom. Elle est
susceptible de subir de nombreuses réduction,notamment en carvomenthol
par hydrogénétion catalytique à hautes température et pression et en
dihydrocarvone en présence de zinc dans l'acide éthanoïque.
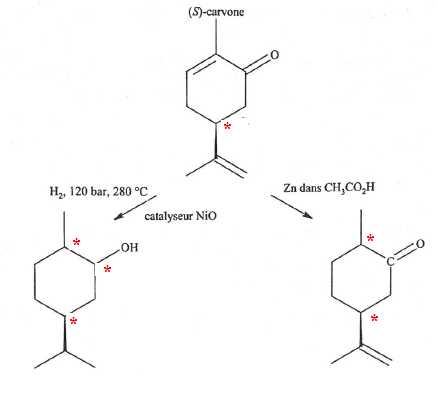
A. La (S)-carvone est une molécule achirale. Faux.
B.
Pour chacune des réactions de la (S)-carvone présenntées ci-dessus, le
dihydrogène et le zinc sont des réactis chimiosélectifs. Faux.
Seul le zinc est chimiosélectif, alors que le dihydrogène réduit à la fois les liaisons double C=C et le groupe carbonyle.
C. Le carvomenthol possède trois atomes de carbone asymétriques. Vrai.
D. Dans la molécule de dihydrocarvone, l'atome de carbone explicitement représenté porte une charge partielle positive. Vrai.
Exercice 8.
L'équation de synthèse de l'acétate d'éthyle est :
CH3COOH +C2H5OH = CH3-COO-CH2-CH3 + H2O.
On présente un protocole expérimental.
Etape 1
: dans un ballon de 100 mL introduire un mélange de 0,25 mol d'acide
acétique et de 0,25 mol d'éthanol. Y ajouter 0,50 mol d'acide
sulfurique concentré et quelques grains de pierre ponce. Porter le
mélange à ébullition ans un dispositif de chauffage à reflux pendant 30
min.
Etape 2 :
laisser refroidir le mélange à l'air ambiant, puis dans un bain d'eau
froide. Verser le contenu du ballon dans une ampoule à décanter
contenant 50 mL d'eau salée. Agiter prudemment quelques instants en
dégazant régulièrement, puis éliminer la phase aqueuse.
Etape 3
: ajouter à la phase organique 60 mL d'une solution aqueuse de
dihydrogénocarbonate de sodium à 1,0 mol/L. Laisser dégazer et
décanter, puis éliminer la phase aqueuse. Recueillir la phase
organique, la sécher sur chlorure de calcium anhydre puis filtrer.
Recuillir le filtrat dans un erlenmeyer propre et sec.
La synthèse permet de recueillir 8,8 mL de filtrat.
A. Le montage de chaufage à
reflux nécessite l'utilisation d'une colonne à distiller de Vigreux.
Faux. (réfrigérant à eau à boules).
B. L'acide sulfurique agit ici comme un facteur cinétique. Vrai, rôle de catalyseur.
C. Lors des étapes 2 et 3, la phase organique occupe la partie supérieure de l'ampoule à décanter. Vrai.
L'ester et l'éthanol ont une densité inférieure à celle de l'eau.
D. Le rendement de cette synthèse est de 37 %. Faux.
Densité : d(acide) =1,05 ; d(alcool) = 0,789 ; d(ester) =0,925.
M(acide) = 60 g/mol ; M(alcool) = 46 g/mol ; M(ester) = 88 g/mol.
Quantité de matière expérimentale d'ester : 8,8 *0,925 / 88 = 0,0925 mol.
On peur espérer obtenir au mieux 0,25 mol d'ester.
Rendement : 0,0925 / 0,25 = 0,0925*4 = 0,37 ( 37 %). Vrai.
Exercice 9.
Dans
un becher de 200 mL muni d'un barreau aimanté et placé sur un agitateur
magnétique, on verse 75 mL d'un mélange eau-éthanol à 50 % dans lequel
on introduit une cellule de conductimétrie. A l'instant de date t=0, on
introduit 2,0 mL de 2-chloro-2-méthylpropane pur dans le becher sous
vive agitation, puis on relève la conductance G du mélange réactionnel
au cours du temps. Les résultats expérimentaux, obtenus à une
tempréature de 20 °C sont présentés sur le graphe ci-dessous.
L'équation de la réaction associée à la transformation, supposée
totale, s'écrit :
RCl aq + 2H2O---> ROH + H3O+aq + Cl-aq.
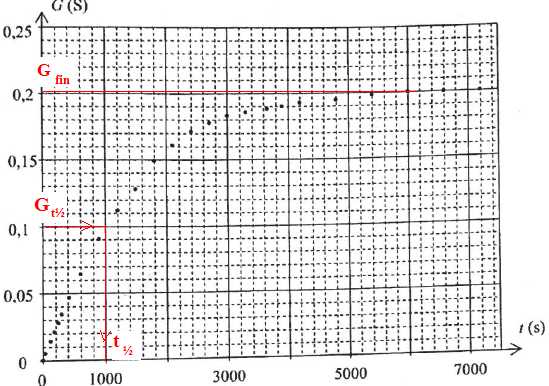
La conductance G, exprimée en siemens (S), du mélange réactionnel est liée à la conductivité s exprimée en S m-1, par G = s
/ K où K est la constante de cellule. On définit, à l'instant t, la
vitesse volumique de la réaction par v(t) = BdG(t) / dt, où B est une
constante.
A. Du point de vue des dimensions, K = l / S où S et l sont respectivement la surface des électrodes de la cellule et la distance qui les sépare. Vrai. K s'exprime en m-1.
B. La vitesse volumique de cette réaction commence par augmenter au cours du temps avant de s'annuler. Faux.
La pente de la tangente à la courbe est maximale à l'instant initial, puis diminue jusqu'à s'annuler ( tangente horizontale).
C. En réalisant une expérience identique à 40°C, le mélange réactionnel atteint la conductance maximale dans un délai plus court. Vrai.
D. Le temps de demi-réaction est d'environ 3000 s. Faux.
Exercice 10.
On asimile le carburant automobile à de l'octane de formule brute C8H18 qui brûle dans l'air lorsqu'il est consommé pour alimenter le moteur du véhicule. Densité de l'octane d = 0,70.
A.
L'octane présente deux stéréoisomères Z/E parmi tous ses isomères. Faux.
L'isomérie de type Z/E ne concerne pas les alcanes.
B. L'équation de la réaction de combustion complète de l'octane dans l'air s'écrit :
C8H18(l) + 25 O(g) --> 8CO2 (g) + 9H2O(g). Faux.
C8H18(l) + 12,5 O2(g) --> 8CO2 (g) + 9H2O(g).
C. Sous une pression donnée, la température d'ébullition de l'octane est supérieure à celle de l'heptane. Vrai.
F. Le véhicule consomme 4,0 L de carburant aux 100 km. L'estimation des émissions de CO2 est légèrment supérieure à 100 g km-1. Faux.
Pour 100 km : masse d'octane m(octane) = 4*0,70 = 2,8 kg
M(octane) =12*8 +18 =114 g/mol ; n(octane) = 2,8 103 / 114 =24,56 mol ;
n(CO2) = 8*24,56 ~196 mol.
M(CO2) = 44 g/mol ; m(CO2) = 44*196 ~ 8,6 103 g.aux 100 km soit ~ 86 g km-1.
|
|