1. Chimie et origine de la vie dans l'espace.
Des
ingrédients considérés comme indispensables pour l'origine de la vie
sur terre ont été découverts dans l'environnement de la comète
67P/Tchourioumov, que la sonde Rosetta a exploré pendant presque deux
ans.
L'atterrisseur de la sonde Rosetta posède un spectromètre infrarouge
capable de détecter la présence de molécules organiques.
Parmi les molécules détectées sur la comète " Tchouri", plusieurs l'ont
été pour la première fois dans une comète. parmi celles-ci, on trouve
le propanal et l'éthanamide.
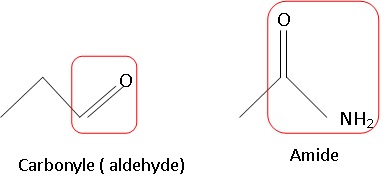
1.1. Présenter les
formules topologiques de ces deux molécules et identifier sur celles-ci
les groupes caractéristiques. Nommer les fonctions associées.
 1.2
1.2. Associer, en
le justifiant, chacun des spectres IR ci-dessous à une des deux
molécules précédentes.
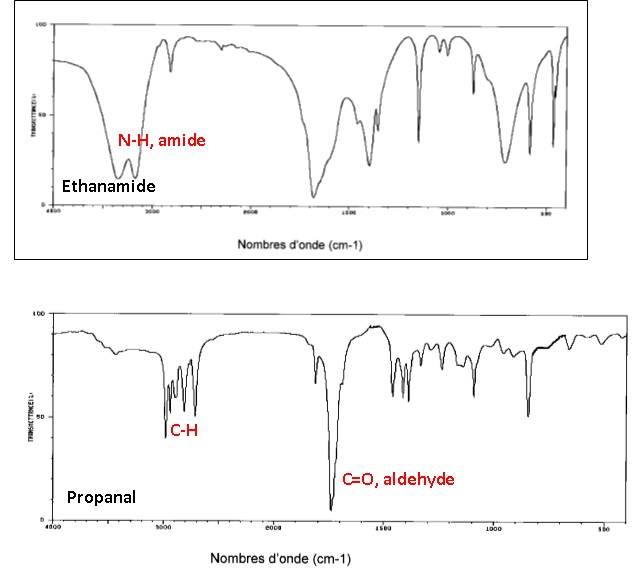
Source : http://sdbs.db.aist.go.jp
La bande forte entre 3100 et 3500 cm
-1 est caractéristique
du groupe amide.
La bande relative à C=O, présente dans les deux spectres, ne
permet pas de disti
nguer
les deus molécules ; les nombres d'onde pour la fonction
aldehyde et la fonction amide sont très proches.