Après récolte et pressage des
raisins, deux fermentations ont lieu, d’abord la fermentation
alcoolique, puis la fermentation malolactique.
Pour qu’un vin puisse être mis en bouteille, il convient de vérifier
que la fermentation malolactique,
objet d’étude de cet exercice, est terminée.
La fermentation malolactique, généralement assurée par une espèce de
bactérie lactique,
Oenococcus oeni, désigne la désacidification biologique du vin. Lors de
cette transformation, l'acide malique présent dans le vin se transforme
en acide lactique, acide plus faible, avec production de dioxyde de
carbone à l’état gazeux ; transformation modélisée par la réaction
d’équation suivante :
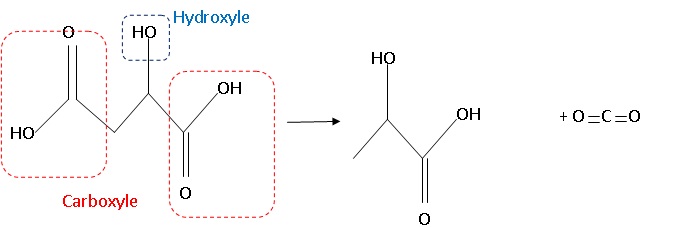
HO2C-CH2-CHOH-CO2H
--> HO2C-CHOH-CH3 +
CO2.
La désacidification du vin qui résulte de la fermentation malolactique
est un phénomène généralement recherché, auquel on doit
l'assouplissement des vins jeunes.
D'après www.vignevin-sudouest.com et http://www.futura-sciences.com
Le 15 octobre 2016, un vigneron suit la fermentation malolactique d’un
vin contenu dans une cuve de 10 m
3. La température ambiante
est de 15 °C lorsque la fermentation malolactique débute. La
concentration massique initiale en acide malique dans le vin est de 3,0
g.L
-1. L’évolution au cours du temps de la masse d’acide
lactique formé est donnée par le graphique suivant.
Données :
- masse molaire de l'acide malique : M
mal = 134,0 g.mol
-1
;
- masse molaire de l'acide lactique : M
lac = 90,0 g.mol
-1
;
- pour simplifier les écritures, on notera les couples acidobasiques,
▪ de l’acide malique :
AH
2/ HA
- : pK
a1 = 3,46 ; AH
-
/ A
2- : pK
a2 = 5,10.
. de l'acide lactique A'H / A'
- : pK
a =
3,86.
1. Stéréochimie.
1.1. Réécrire
l'équation de la réaction chimique modélisant la transformation de
l'acide malique en
acide lactique en utilisant les formules topologiques des molécules.
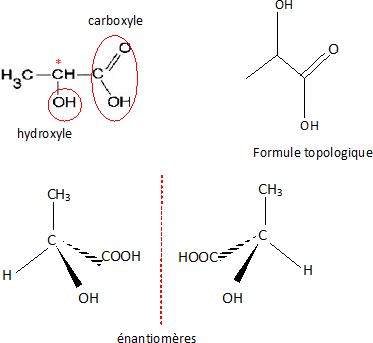
1.2. Entourer et
nommer les groupes caractéristiques présents dans la molécule d'acide
malique.
1.3. À l’aide de la représentation de Cram, dessiner les stéréoisomères
de la molécule d’acide
lactique.