La
benzoïne est une molécule utilisée dans de nombreux domaines de
l’industrie chimique, en pharmacologie et cosmétique par exemple.
Le but de cet exercice est d’étudier trois protocoles de synthèse de la
benzoïne à partir du benzaldéhyde et de les comparer, au regard de la
chimie verte.
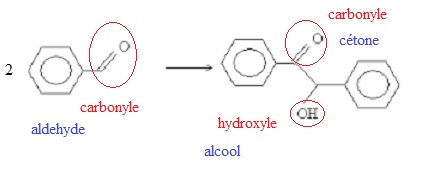
L’équation de la réaction de synthèse est représentée ci-dessous.
1. Les molécules
intervenant dans la synthèse.
Recopier l’équation de la réaction de synthèse.
Entourer les groupes caractéristiques du réactif et du produit, puis
nommer les fonctions correspondantes
.
2. La méthode ZININ
1839
La méthode ZININ est l’une des premières méthodes de synthèse de la
benzoïne à partir du benzaldéhyde, utilisant les ions cyanure comme
catalyseurs.
Protocole de la
synthèse :
Travailler sous une hotte aspirante.
Porter constamment une paire de gants de protection.
Récupérer les déchets dans un récipient de stockage approprié.
1. Dans un ballon à fond rond de 250 mL équipé d'un réfrigérant,
introduire environ 20 mL d'éthanol, 15,0 mL de benzaldéhyde et 15,0 mL
d'une solution aqueuse à 10% en cyanure de potassium.
2. Chauffer à reflux durant 30 minutes.
3. Refroidir le ballon et son contenu dans un mélange (eau +
glace + sel) : la benzoïne cristallise.
4. Filtrer sur filtre Büchner.
5. Laver le résidu solide avec 50 mL d'eau distillée glacée.
6. Essorer et sécher à l'étuve réglée à 100 ° C penda nt 20 minutes.
7. Recristalliser le produit brut dans l'éthanol.
8. Filtrer sur filtre Büchner.
9. Essorer et sécher à l'étuve réglée à 100 ° C duran t 20 minutes.
10. Mesurer la température de fusion et la masse de benzoïne solide
obtenue.
Résultats : T
fusion = 137 ° C
m
obtenue = 7,81 g
2.1. Analyse du
protocole de synthèse.
2.1.1. Justifier
les mesures de sécurité préconisées.
L'éthanol et le benzaldehyde sont nocifs et irritants : utiliser des
gants et travailler sous hotte aspirante.
Le cyanure de potassium est toxique et dangereux pour l'environnement.
Ce catalyseur est régénéré en fin de réaction : récupérer les déchets
dans un récipient approprié.
2.1.2. Dans un
protocole de synthèse apparaissent quatre étapes :
synthèse – séparation – purification – identification.
Repérer ces différentes étapes successives dans les opérations du
protocole de synthèse de la benzoïne.
Synthèse : 1. 2.
Séparation : 3. 4.
Purification : 5. à 9..
Identification : 10..
2.1.3. Justifier le
choix de la température de l’étuve.
Le produit formé ne doit pas fondre.
Les traces d'eau et d'éthanoldoivent s'évaporer.