Eliminer le
tartre,
bac
S Métropole 2017 .
|
|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
Dans nos maisons, les dépôts de
tartre sont nombreux. Ils se forment sur les robinets, dans les
baignoires,
les lavabos, les éviers, les lave-linge… Ces dépôts de tartre sont
constitués de carbonate de calcium, de
formule CaCO3(s). Ils peuvent être dissous en utilisant des
solutions acides telles que les solutions de
détartrants commerciaux.
1. Détermination de la
concentration en acide chlorhydrique d’un détartrant commercial.
L’étiquette d’un détartrant commercial indique : « acide chlorhydrique
à 9 % » ce qui correspond à 9,0 g de
HCl (g) dissous dans de l’eau pour obtenir 100 g de solution
détartrante. HCl (g) réagit totalement avec l’eau
pour former une solution d’acide chlorhydrique (H3O+(aq)
+ Cl – (aq)).
1.1. Montrer que la
concentration molaire en acide chlorhydrique de la solution commerciale
est de l’ordre
de 2,6 mol.L-1.
Masse
volumique de la solution commerciale de détartrant : 1,04 × 103
g.L-1 ;
90 g de HCl (g) dissous dans de l’eau pour
obtenir 1000 g de solution détartrante soit dans un volume :
V = 1000 / (1,04 103)= .0,9615 L.
M(HCl) = 36,5 g/mol.
Quantité de matière HCl correspondante : 90 / 36,5 =2,4657 mol
Concentration molaire en acide chlorhydrique : 2,4657 / 0,9615 = 2,56 ~2,6 mol/ L.
On souhaite vérifier ce résultat. Pour cela,
on réalise le titrage de 10,0 mL de détartrant par une solution
d’hydroxyde de sodium (Na+(aq) + HO-(aq)) de
concentration molaire cb égale à 1,0 × 10-1 mol.L-1.
L’équation support du titrage est : H3O+(aq) + HO-(aq)
→ 2 H2O(l).
1.2. Identifier les
couples mis en jeu dans cette réaction acido-basique.
H3O+(aq)
/ H2O(l) et H2O(l) / HO-(aq).
1.3. Montrer que,
dans ces conditions, le volume de solution d’hydroxyde de sodium qu’il
faudrait verser pour atteindre l’équivalence est supérieur au volume de
la burette graduée de 25,0 mL.
A l'équivalence CA VA = CB Véq
; Véq = CA VA / CB.
Véq =2,6 x10 /
0,10 = 2,6 102 mL.
Lors d’une activité expérimentale réalisée en
classe, les élèves préparent une solution S en diluant 20 fois le
détartrant commercial. Ils réalisent le titrage conductimétrique d’un
volume VS = 10,0 mL de la solution S par une solution
d’hydroxyde de sodium de concentration cb = 1,0 × 10-1
mol.L-1, après avoir ajouté de l’eau distillée à la solution
S.
|
|
|
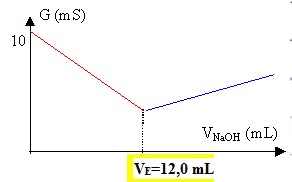
1.4. Comment les
élèves ont-ils résolu le problème soulevé à la question 1.3. ?
En diluant 20 fois la solution commerciale, on divise par 20 sa
concentration.
Le volume équivalent sera divisé par 20 soit 260 / 20 = 13 mL.
1.5. Déterminer la
concentration molaire en ions H3O+(aq) dans la
solution diluée S. Ce résultat est-il compatible avec l’indication de
l’étiquette du détartrant ?
CA VA = CB Véq
; CA = CB
VE / VA.
Concentration molaire de la solution S : CA =12,0 x0,10 / 10
= 0,12 mol/L.
Concentration molaire de la solution
commerciale : 20 x 0,12 = 2,4 mol / L.
Ecart relatif : (2,56-2,4) / 2,56 = 0,0625 ( 6,3 %).
Ce résultat est compatible
avec l’indication de l’étiquette du détartrant.
|
|
|
|
Utilisation
domestique du détartrant commercial
L’acide chlorhydrique agit sur le tartre selon la réaction d’équation :
2 H3O+(aq) + CaCO3(s) → Ca2+(aq)
+ CO2(g) + 3 H2O(l)
On souhaite détartrer la surface extérieure du tambour cylindrique
fermé d’un lave-linge recouvert d’une épaisseur de calcaire d’environ
10 μm. Rayon du tambour R = hauteur du tambour h = 40 cm.
Étant donnée la faible épaisseur de la couche de tartre, son volume est
approximativement égal au produit de la surface extérieure du
tambour par l’épaisseur de la couche de tartre.
2.1. Estimer le
volume total de tartre déposé sur la surface extérieure du tambour du
lave-linge.
Surface latérale du cylindre : 2pRh
= 2 x3,14 x0,40 x0,40 = 1,0048 m2.
Surface des deux bouts : 2 p
R2 = 2 x3,14 x0,402 = 1,0048 m2.
Surface totale de tartre : 2,0096 m2.
Volume de tartre = surface x épaisseur.
V = 2,0096 x 10-5 ~2,0 10-5 m3 = 20
mL.
Un
flacon contient 750 mL de détartrant commercial de concentration
molaire en ions H3O+(aq) égale à 2,4 mol.L-1.
2.2. Ce flacon
est-il suffisant pour détartrer totalement le tambour du lave-linge ?
Masse volumique du tartre : 2,65 g / mL
Masse de tartre : 2,65 x 20 = 53 g.
M(tartre) = 100,1 g / mol.
Quantité de matière de tartre : n = 53 / 100,1 ~0,53 mol.
Quantité de matière d'acide nécessaire = 2 n =1,06 mol, d'après les
nombres stoechiométrique de l'équation.
Volume d'acide nécessaire :
1,06 / 2,4 ~0,44 L ou 4,4 102 mL.
Cette valeur étant inférieure au volume du flacon, ce dernier permet le
détartrage du tambour.
|
|