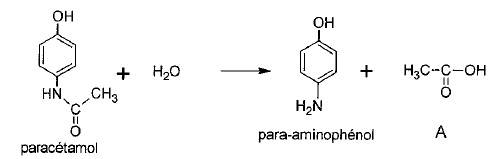
Paracétamol,
Bac S Antilles 09 / 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
Exercice
1. (9 points)
Objectif : vérifier la masse de paracétamol dans un comprimé de Doliprane 500 mg.
Hydrolyse du paracétamol en para-aminophénol.
Un comprimé est dissout dans un ballon contenant 40 mL d'une solution
sulfurique que l'on chauffe à reflux pendant une heure. Lae paracétamol
est hydrolysé. On refroidit ensuite le ballon sous un courant d'eau
froide. On verse le contenu du ballon dans une fiole jaugée de 100 mL
et on complète jusqu'au trait de jauge avec de l'eau distillée. Soit S1 cette solution contenant le para-aminophénol à la concentration C1.
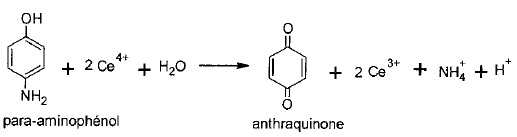
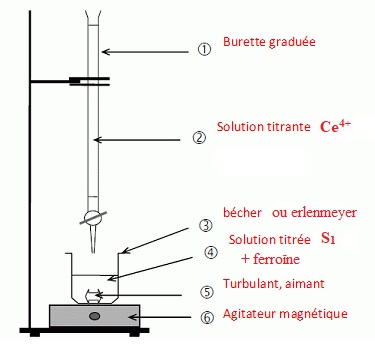
Titrage du para-aminophénol par les ions cérium IV, Ce4+.
On prélève V1 = 10,0 mL de la solution S1 que
l'on place dans un erlenmeyer. On ajoute 20 mL d'eau, 20 g de glace
pilée, 12 mL de solution d'acide sulfurique et 2 gouttes de solution de
ferroïne ( indicateur coloré ). La solution titrante d'ion cérium IV a
une concentration C2 = 5,00 10-2 mol / L. Le volume équivalent est égal à VEq = 13,1 mL.
On donne l'équation de la réaction support du titrage.
1.1.
Nommer les fonctions associées aux groupes caractéristiques comportant
un atome d'azote présents dans le paracétamol et dans le
para-aminiophénol.

1.2. Nommer le sous-produit A formé lors de l'hydrolyse.
Acide éthanoïque ou acétique.
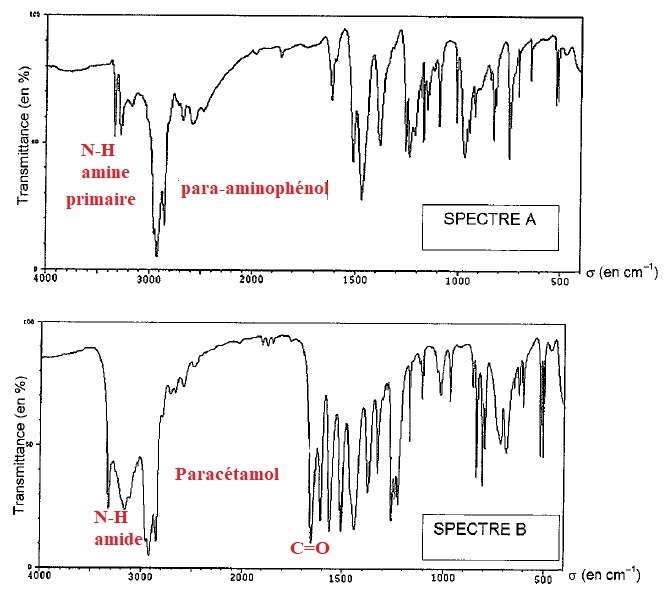
1.3. Les spectres donnés ci-dessous donnant la transmittance en fonction du nombre d'onde ( cm-1) sont ceux du para-aminophénol et du paracétamol.
3.1.1 De quel type de spectroscopie s'agit-il ? Justifier quantitativement..
Spectre d'absorption infra rouge.
4000 cm-1 = 1 / 4000 cm = 2,5 10-4 cm = 2,5 µm ( domaine IR).
1000 cm-1 = 1 / 1000 cm = 1 10-3 cm = 10 µm ( domaine IR).
3.1.2 Attribuer à chaque espèce chimique le spectre correspondant.
|
|
|
|
|
1.4.
Le spectre RMN simulé ci-dessous est celui du paracétamol. Identifier
le signal correspondant aux atomes d'hydrogène du groupe CH3. Justifier la multiplicité du signal.
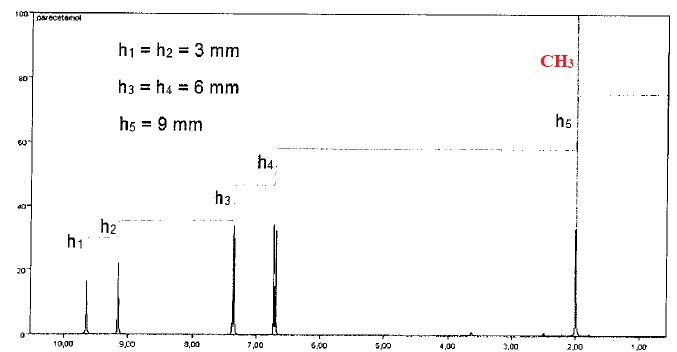
Le carbone voisin ne porte aucun proton, le signal du groupe CH3 est donc un singulet.
1.5. Préciser les précautions à prendre en lien avec la sécurité pour la mise en oeuvre du montage à reflux.
L'acide sulfurique est corrosif , le para-aminophénol est cancèrogène
et dangereux pour l'environnement : port de blouse, gants et lunette de
protection ; travail sous hotte aspirante.
1.6 A quelle
catégorie de réaction appartient l'hydrolyse du paracétamol ?
Prérciser s'il s'agit d'une modification de chaine ou de groupe
caractéristique. Justifier.
La chaine carbonnée n'est pas modifiée. Le groupe CO-CH3 est remplacé par H. Il s'agit d'une réaction de substitution.
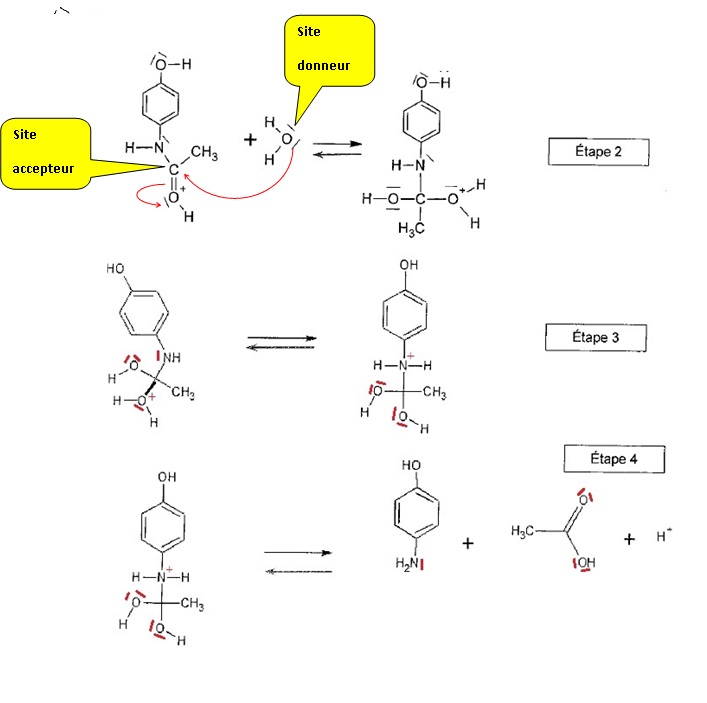
1.7. On donne les différentes étapes du mécanisme réactionnel de l'hydrolyse.
1.7.1. Pour les étapes 3 et 4 compléter les schémas en faisant apparaître les doublets non-liants non représentés.
1.7.2. Pour l'étape
2, identifier les sites donneur et accepteur de doublets d'électrons
qui interviennent et compléter le mécanisme par des flèches courbes.
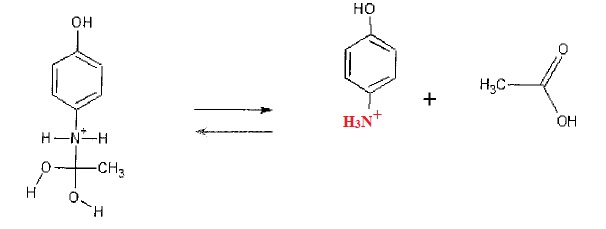
1.8. Compte tenu
des conditions du milieu réactionnel, déterminer, en fin de réaction,
la forme prédominante sous laquelle se trouvent le para-aminophénol et
l'acide acétique. proposer une nouvelle écriture de la dernière étape
du mécanisme.
En milieu acide sulfurique ( pH < 5), l'acide acétique est sous la forme CH3-COOH et le paraéminophénol sous la forme 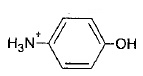
|
|
2. Etude du titrage du para-aminophénol par les ion cérium IV.
2.1. Schématiser le dispositif expérimental mis en oeuvre pour réaliser ce titrage.
2.2. La réaction support du
titrage est une réaction d'oxydo-réduction. Le réactif titrant joue
-t-il le rôle d'oxydant ou de réducteur ? Justifier.
Ce4+ +e- ---> Ce3+.
L'oxydant Ce4+ gagne un électron, il se réduit.
2.3 Parmi les 4 propositions suivantes, déterminer celle qui est correcte. Justifier.
A l'équivalence, la quantité de matière du paracétamol initialement présente est :.
A. la quantité de matière de Ce4+ versée à l'équivalence.
B. 2 fois la quantité de matière de Ce4+ versée à l'équivalence.
C. la moitié de la quantité de matière de Ce4+ versée à l'équivalence. Vrai.
D. 2 fois la quantité de matière de Ce3+ formé.

D'après les nombres stoechiométriques, à l'équivalence, la quantité de matière de Ce4+ est égale à 2 fois la quantité de matière de para-aminophénol.
n(para-aminophénol) = n(paracétamol ) = 0,5 n(Ce4+).
2.4. Déterminer la masse de paracétamol contenue dans un comprimé.
n(Ce4+) = C2 Véq = 5,00 10-2 x 13,1 10-3 = 6,55 10-4 mol.
n(paracétamol ) = 0,5 n(Ce4+) = 3,275 10-4 mol dans 10 mL de S1.
Soit 3,275 10-3 mol dans 100 mL de S1, dans un comprimé.
Masse de pracétamol = 3,275 10-3 M(paracétamol) = 3,275 10-3 x151 ~0,494g = 494 mg.
2.5. Citer deux éventuelles sources d'écart possibles, avec la valeur indiquée sur l'étiquette.
Erreur sur les volumes V1 et Véq.
Erreur sur la concentration C2 d'ion Ce4+.
|
|