Contrôle
du dioxyde de carbone dans l'eau d'un aquarium, bac S Nlle Calédonie
2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
......
.....
|
L’eau d’un aquarium est
un milieu fragile contenant de nombreuses espèces chimiques. Il faut
maintenir la qualité de l’eau afin d’assurer le bon développement des poissons et de
leur environnement végétal.
Le dioxyde de carbone étant essentiel pour la bonne croissance des
plantes d’un aquarium, il est fréquent d’installer un dispositif qui libère ce gaz dans l’eau de l’aquarium,
où il se dissout. Cependant, en trop grande quantité dans l’eau, le dioxyde de carbone est toxique pour les
poissons. Il est donc important de contrôler régulièrement la concentration du dioxyde de carbone dans l’eau d’un
aquarium.
L’objectif de cet exercice est de déterminer la concentration du
dioxyde de carbone dissous dans l’eau d’un aquarium par une méthode de titrage.
Données :
masse molaire moléculaire du dioxyde de carbone : M(CO2) = 44,0
g.mol-1 ;
couples acide / base : (CO2, H2O)/HCO3 - (aq) ; HCO3 - (aq)/CO32-(aq)
;
On donne ci-dessous, le diagramme de distribution des espèces (CO2, H2O), HCO3 - (aq) et
CO32-(aq) :
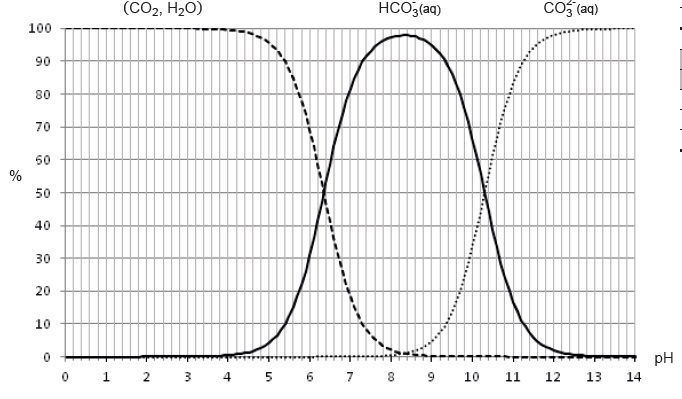
Ce diagramme donne, à 25°C, les proportions molaires (en %) des
différentes espèces acido-basiques provenant du dioxyde de carbone
dissous dans l’eau, en fonction du pH de la solution.
Les cellules grisées du tableau ci-dessous indiquent des pH et des
domaines de concentration massique en dioxyde de carbone dissous
correspondant à des conditions optimales pour les plantes et les
poissons dans l’eau de l’aquarium.

Exemple de lecture : pour un pH de 7,0 et une concentration massique en CO2 dissous comprise entre
15 mg.L-1 et 27 mg.L-1, les conditions sont optimales.
|
...
|
|
1. Du dioxyde de carbone dans un aquarium
On s’intéresse aux couples : (CO2, H2O)/HCO3 - (aq) et HCO3 - (aq)/CO32-(aq) de pKa respectifs pKa1 et pKa2.
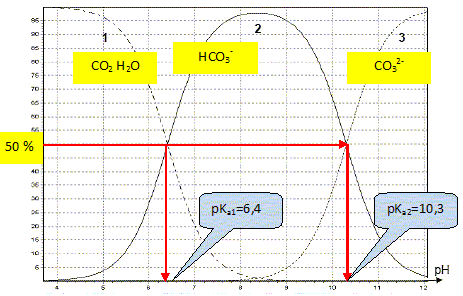
1.1. À l’aide du diagramme de distribution des espèces, montrer que la valeur de pKA1 est égale à 6,4, puis
déterminer la valeur de pKA2.
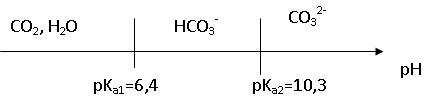
1.2. Sur un même axe gradué de pH, délimiter et faire figurer les domaines de prédominance des espèces chimiques (CO2, H2O) , HCO3 - (aq) et CO32-(aq).
1.3. Le pH d’une
eau vaut 7,4. À l’aide d’un raisonnement qualitatif, indiquer comment
le pH de cette eau évolue lorsqu’on y introduit du dioxyde de carbone.
CO2, H2O + H2O =HCO3- aq + H3O+aq.
Cet équilibre évolue dans le sens direct, consommation de dioxyde de carbone et formation d'ion H3O+aq. Le pH de la solution diminue.
|
| ... |
....
|
2. Contrôle du dioxyde de carbone dans l’eau d’un aquarium par titrage
La concentration en dioxyde de carbone dans l’eau de l’aquarium est
liée au pH et à la concentration des ions hydrogénocarbonate HCO3 -
(aq). Il est possible de déterminer la concentration en dioxyde de
carbone en réalisant le titrage acido-basique suivi par pH-métrie des
ions hydrogénocarbonate présents dans l’eau de l’aquarium à l’aide
d’une solution d’acide chlorhydrique (H3O+(aq) +Cl − (aq)).
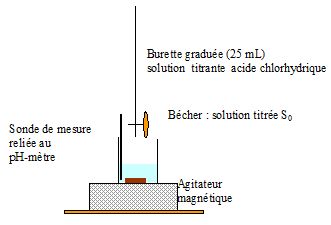
Pour cela, on prélève 100,0 mL d’eau de l’aquarium qu’on titre par une
solution d’acide chlorhydrique de concentration molaire 5,0 × 10-2 mol.L-1.
2.1. Faire un schéma légendé du dispositif expérimental de titrage.
Les valeurs du pH en fonction du volume d’acide chlorhydrique versé au cours du titrage sont reportées.
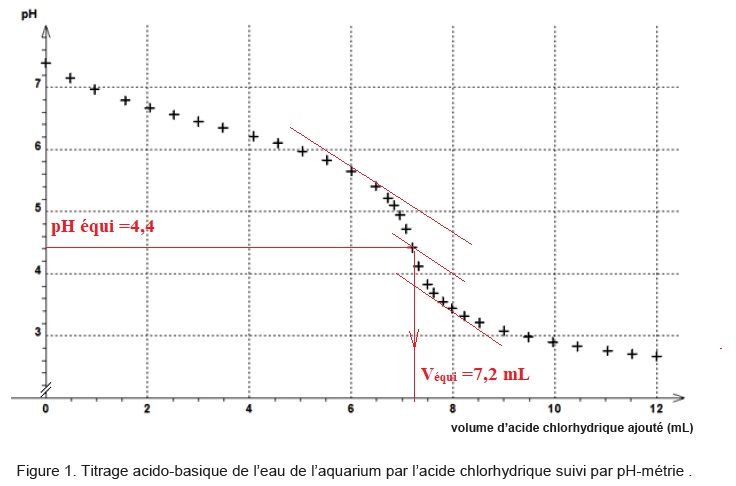
2.2. Parmi les trois espèces CO32-(aq), HCO3 - (aq) et (CO2, H2O), déterminer l’espèce prédominante :
- dans l’eau de l’aquarium ;
à pH=7,4, HCO3 - (aq) prédomine.
- dans la solution à l’équivalence du titrage.
à pH équi = 4,4, (CO2, H2O) prédomine.
2.3. Écrire l’équation de la réaction support de titrage des ions hydrogénocarbonate par l’acide chlorhydrique.
HCO3 - (aq) +H3O+(aq) ---> CO2 aq + 2H2O.
2.4. Estimer la concentration molaire des ions hydrogénocarbonate dans l’eau prélevée dans l’aquarium.
A l'équivalence : [HCO3 - (aq)] = 5,0 10-2 x 7,2 / 100,0 =3,6 10-3 mol/ L.
2.5. La relation permettant d’estimer la concentration molaire en dioxyde de carbone dissous dans l’eau de
l’aquarium est la suivante : [CO2, H2O] = [HCO3 - (aq)] × 10(pKA1 – pH).
En considérant que [CO2, H2O] =[CO2 dissous], déterminer la valeur de la concentration massique en dioxyde de carbone dissous dans l’eau de l’aquarium.
[CO2, H2O] = 3,6 10-3× 10(6,4 -7,4) =3,6 10-4 mol /L soit 3,6 10-4 x44 ~1,6 10-2 g/L ou 16 mg / L.
2.6. Les conditions pour les plantes et les poissons sont-elles optimales ? Justifier.
Pour un pH de 7,4 et une concentration massique en CO2 dissous comprise entre 11 mg.L-1 et 23 mg.L-1, les conditions sont optimales.
|
|