Crème
anesthésiante, Bac S métropole 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
1. Etude de la molécule de lidocaîne.
1.1. Recopier la formule 2, entourer les groupes caractéristiques et nommer les familles chimiques correspondantes.
1.2.
identifier sur la formule 3 le(s) groupe(s) de protons équivalents
correspondant au quadruplet situé à 2,7 ppm et ceux correspondant au
triplet situé à 1,1 ppm sur le spectre RMN. Justifier.
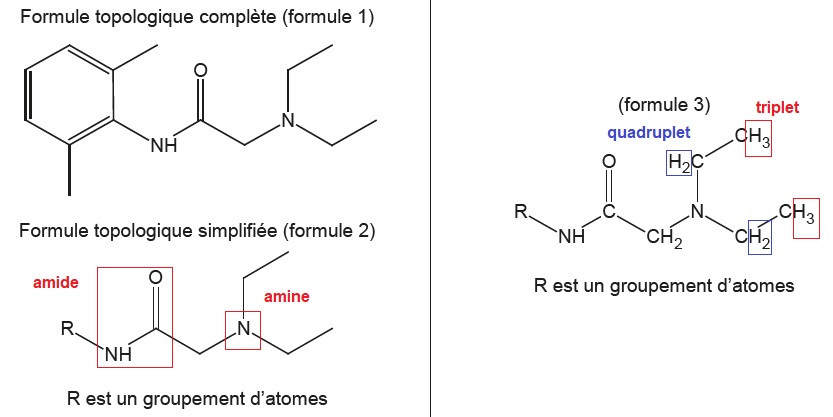
Spectre RMN : les protons équivalents du groupe méthyle CH3 donnent un triplet, le carbone voisin porte deux protons.
Les protons équivalent du groupe CH2 donne un quadruplet, le carbone voisin porte 3 protons.
Synthèse de la lidocaïne.
L'équation de la réaction de synthèse est la suivante.
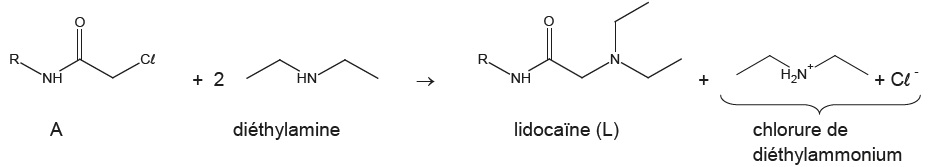
Protocole.
Etape 1 : introduire 6,00 g ( 3,0 10-2 mol) de
N-(2,6-diméthylphényl)chloroacétamide, noté A, dans un ballon de 250
mL. Ajouter 60 mL de toluène ( solvant) et 15 mL ( 0,15 mol) de
diéthylamine puis chauffer à reflux sous agitation pendant 1 h 30 min.
Etape 2 : après élimination du diéthylamine restante et du chlorure de
diéthylammonium formé, traiiter le milieu restant après ajout de 30 mL
d'une solution aqueuse d'acide chlorhydrique concentré. A l'aide d'una
ampoule à décanter, récupérer la phase aqueuse qui renferme la forme
acide associée à la lidocaïne synthétisée.
Etape 3 : faire précipiter la lidocaïne à l'aide d'une solution d'hydroxyde de sodium.
Etape 4 : après filtration et séchage, on obtient une masse de lidocaïne mL = 5,6 g.
Le rendement usuel de cette synthèse est supérieur à 70 %.
|
|
|
|
|
2. 1. Mise en oeuvre du protocole expérimental.
2.1.1. Indiquer l'intérêt du chauffage à reflux.
La température est un facteur cinétique. En travaillant à température
plus élevée, on accélère la réaction tout en évitant les pertes de
matière : les vapeurs se condensent dans le réfrigérant et retombent
dans le milieu réactionnel.
2.1.2. Vérifier que le réactif A est le réactif limitant.
Une mole de A réagit avec 2 mol de diéthylammine.
0,030 mol de A réagit avec 0,06 mol de diéthylamine. Or on en a introduit 0,15 mol. Celle-ci est en excès.
2.1.3. Déterminer la valeur du rendement et commenter.
On peut espérer obtenir au mieux 0,030 mol de lidocaïne.
mthéorique = 0,030 M (lidocaïne) = 0,030 x234,3 = 7,0 g.
Rendement = masse expérimentale / masse théorique x 100 = 5,6 / 7 x100 = 80 %.
Cette valeur est cohérente avec l'énoncé.
2.2. Mécanisme réactionnel.
Première étape du mécanisme.
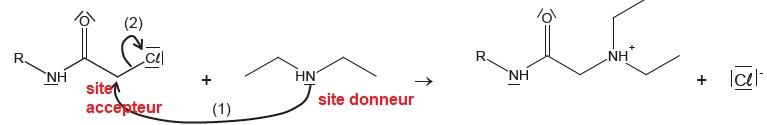
Que représentent les flèches courbes ? Identifier le site accepteur et le site donneur associés à la flèche 1.
Les flèches courbes traduisent le déplacement d'un doublet d'électrons.
|
|
3. Etude d'une crème anesthésiante.
La crème contient 2,5 % en masse de lidocaïne.
Lorsque la crème est appliquée sur la peau, les principes actifs
diffusent à travers les couches de la peau pour atteindre des
terminaisons nerveuses. On admet qu'une quantité de 10-7 mol de lidocaïne par cm2 de peau est suffisante pour l'anesthésie. L'épaisseur de crème appliquée est de l'ordre de 1 mm.
3.1. Vérifier que la quantité de matière de lidocaïne dans cette crème est égale à 1,1 10-4 mol / cm3.
Masse volumique de cette crème 1,0 g cm-3.
2,5 g de lidocaïne pour 100 g de crème, soit : 2,5 10-2 g de lidocaïne par cm3 de crème.
2,5 10-2 / 234,3 = 1,067 10-4 ~1,1 10-4 mol / cm3.
3.2. Montrer qu'une épaisseur de 0,1 mm de crème anesthésiante est suffisante sur une zone de 1 cm2 de peau est suffisante pour anesthésier cette zone.
Volume de crème : épaisseur x surface =0,01 x1 = 0,01 cm3.
Quantité de matière correspondante : 1,1 10-6 mol, valeur supérieure à 10-7 mol.
|
|