Le
projet éolien hydrogène d'Utsira,
bac STI2D, STL Nlle Calédonie 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
PARTIE A - LES ÉOLIENNES
puissance nominale : 600 kW ; diamètre du rotor: 40 m ; surface balayée : 1 257 m2 ; nombre de pâles : 3.
A.1 Besoins en énergie électrique.
Dans un premier temps, nous allons étudier l'énergie électrique que
nous pouvons récupérer par l' installation de deux éoliennes,
différents paramètres pouvant influencer le fonctionnement de
l'éolienne.
A.1.1 D'après leurs caractéristiques, quelle est l'énergie maximale que peuvent fournir les deux éoliennes en un an (en kW.h) ?
2 x 600 x365 x24 =1,05 107 kWh / an = 1,05 104 MWh / an.
A.1.2 Est-ce suffisant pour alimenter en énergie électrique l'île d'Utsira ? Justifier.
A.1.3 Est-il vraiment nécessaire d'avoir 2 éoliennes ? Justifier.
La consommation de l'île est d'environ 3 500 MW.h/an, la pointe de consommation en hiver étant de l'ordre de 900 kW.
La plus longue période de vent nul s'avère de l'ordre de deux jours.
La production d'énergie électrique par les éoliennes est intermittente.
Il faut donc envisager de stocker le surplus d'énegie électrique quand
sa consommation est faible.
A.1.4 Compléter la chaine énergétique de l'éolienne en indiquant les types d'énergie mis en jeu.
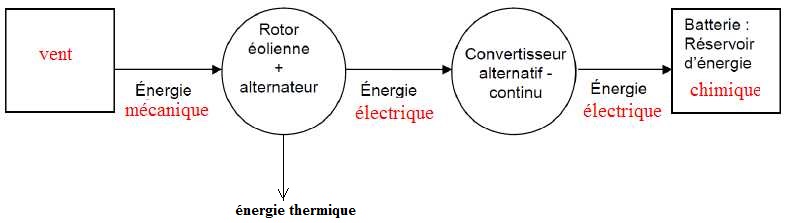 A.2 Principe de fonctionnement d'une éolienne.
A.2 Principe de fonctionnement d'une éolienne.
L'énergie produite par l'éolienne provient de l'énergie cinétique de l'air : Ec =0,5 mv2.
Ec : l'énergie cinétique de l'air (J)
v : la vitesse du vent (m.s-1)
m : la masse de l'air balayant l'éolienne (kg)
S étant la surface de la section (m2 ) balayée par l'éolienne, on cherche à exprimer la masse d'air, m, passant au travers de la section, S, pendant une durée Dt.(s).
A.2.1. Exprimer le volume d'air, Vair contenu dans un cylindre (de section S, et de longueur d = v x Dt en fonction de S, v et Dt.
Vair = S v Dt.
A.2.2 Sachant que r est la masse volumique de l'air, en déduire l'expression de la masse d'air correspondante.
m = r S v Dt.
A.2.3 En déduire que l'énergie cinétique de cette masse d'air, m, s'exprime selon : Ec = 0,5 r S v3 Dt.
Ec = 0,5 r S v Dt v2 = 0,5 r S v3 Dt.
A.2.4 À partir de l'expression de l'énergie cinétique de la masse d'air, déduire celle de la puissance du vent, Pvent reçue par l'éolienne.
Pvent = Ec / Dt =0,5 r S v3 .
A.2.5 Seule une partie de l'énergie cinétique est transformée en énergie mécanique de rotation du rotor de l'éolienne.
On donne la relation suivante : Pméca = ap x Pvent
Pméca : puissance mécanique au niveau du rotor
Pvent : puissance du vent
ap : coefficient de puissance de l'éolienne
Donnée : masse volumique de l'air à 15 °C sous une pression atmosphérique standard : r = 1,23 kg.m·3.
Sachant que le coefficient de puissance est de 59 % (au maximum),
calculer la puissance mécanique maximale récupérée pour un vent de 10
m.s-1.
Pvent = 0,5 x1,23 x1257 x103 =7,73 105 W.
Pméca = 0,59 x7,73 105 = 4,56 105 ~4,6 105 W.
A.2.6 On s'intéresse maintenant au rendement de l'éolienne défini par h = Pélec / Pvent
À l'aide de la caractéristique fournie par le constructeur :
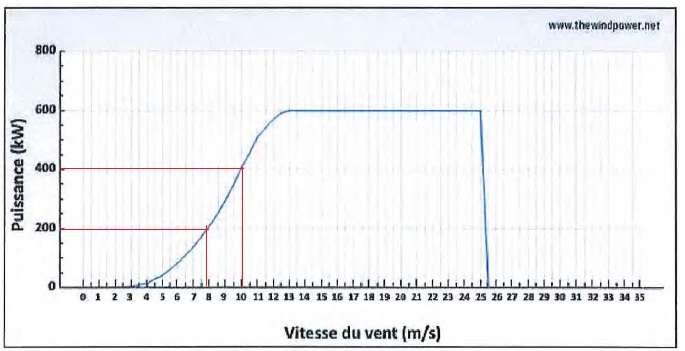
Compléter le tableau en expliquant la méthode utilisée.
vitesse du vent (m /s)
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
18
|
20
|
Pvent ( kW)
|
6
|
49
|
166
|
394
|
770
|
1330
|
2110
|
3150
|
4190
|
6160
|
Pélec ( kW)
|
0
|
20
|
75
|
200
|
400
|
550
|
600
|
600
|
600
|
600
|
rendement (%)
|
0
|
41
|
45
|
51
|
52
|
41
|
28
|
19
|
14
|
10
|
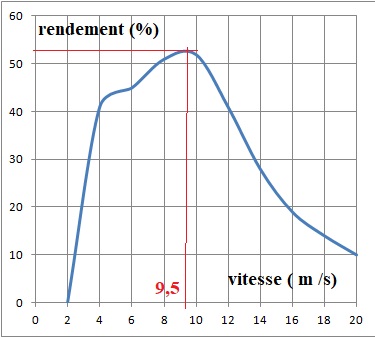
Tracer la courbe de variation du rendement en fonction de la vitesse du vent ;
en déduire la vitesse du vent permettant d'avoir le meilleur rendement.
|
A.3 Énergie récupérable par les deux éoliennes de l'île d'Utsira.
Le vent n'est pas une source d'énergie constante. Selon le site où
l'éolienne est implantée, elle permet de fournir plus ou moins
d'énergie en fonction de la vitesse du vent.
On dispose de la vitesse moyenne du vent chaque mois sur l'île d'Utsira. Compléter le tableau en déterminant la puissance électrique fournie par une éolienne pour chaque mois.
mois
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
vitesse moyenne ( m/s)
|
10
|
9
|
8
|
7
|
8
|
7
|
7
|
7
|
8
|
10
|
9
|
10
|
puissance électrique ( kW)
|
400
|
300
|
200
|
140
|
200
|
140
|
140
|
140
|
200
|
400
|
300
|
400
|
énergie ( MWh)= Puissance (MW) x30 x24
|
288
|
216
|
144
|
101
|
144
|
101
|
101
|
101
|
144
|
288
|
216
|
288
|
A.3.2 En déduire l'énergie électrique récupérée, Erec
(en kW.h), par les deux éoliennes d'Utsira pendant une année (pour
simplifier, on considérera que tous les mois ont une durée de 30 jours).
2 (288 +216 +144 +101 +144 +101 +101+101 +144 +288 +216 +288)~4,3 103 MWh.
A.3.3 Comparer avec la valeur trouvée à la question A.1.1 et conclure en utilisant la réponse à la question A.1.2.
L'énergie électrique récupérée représente environ 40 % de l'énergie maximale. Cela reste suffisant pour alimenter cette île.
PARTIE B - LA PRODUCTION DE DIHYDROGÈNE
La consommation d'électricité ne correspond pas toujours à la production. Il est ainsi prévu, en cas de surproduction, de stocker l'énergie supplémentaire en produisant du dihydrogène par électrolyse.
B.1 Dans le cas d'Utsira, le dihydrogène est choisi principalement comme mode de stockage de l'énergie récupérée par électrolyse. Par ailleurs, il est possible de produire du dihydrogène par reformage. Préciser les avantages et inconvénients des deux modes de production de dihydrogène
La production de dihydrogène par reformage produit du CO2, gaz à effet de serre, le coût rest assez faible et cela nécessite de grosses unités de production.
La production de dihydrogène par électrolyseen utilisant de
l'électricité produite par les énergie renouvelables ne contribue pas à
l'effet de serre. La production peut être répartie dans de petites
unités. Son coût reste élevé et le rendement est faible.
B.2 Électrolyseur.
En expliquant le fonctionnement de l'électrolyseur, nous allons évaluer la valeur de l'intensité du courant nécessaire pour produire 10 m3 de dihydrogène en une heure.
Une cellule d'électrolyse est constituée de deux électrodes trempant dans un électrolyte ; un générateur de tension continue maintient une tension voisine de 2 V et permet de disposer d'une intensité de courant électrique de plusieurs kiloampères.
L'équation de fonctionnement de l'électrolyse s'écrit: 2 H20 ---> 2 H2(g) + O2(g).
8.2.1 Rappeler la définition d'un oxydant et celle d'un réducteur.
Un oxydant est une espèce chimique susceptible de gagner un ou plusieurs électrons.
Un réducteur est une espèce chimique susceptible de céder un ou plusieurs électrons.
8.2.2 Les couples d'oxydoréduction qui participent à l'électrolyse sont : 02(g) / H2O(l) et H+aq / H2(g).
8.2.2.a Écrire la demi-équation de la réaction de réduction correspondant à la formation du dihydrogène.
4H+aq +4e- =2 H2(g)
8.2.2.b La demi-équation associée au couple 02(g) / H2O(l)
O2(g) + 4H+ +4e- = 2H2O(l)
D'après les deux demi-équations, justifier l'écriture de l'équation de fonctionnement de l'électrolyse.
Ajouter les deux demi-équations suivantes puis simplifier.
4H+aq +4e- =2 H2(g)
2H2O(l) =O2(g) + 4H+ +4e- .
2H2O(l) +4H+aq +4e- =O2(g) + 4H+ +4e- +2 H2(g)
2H2O(l) =O2(g) +2 H2(g).
|
|
...
|
|
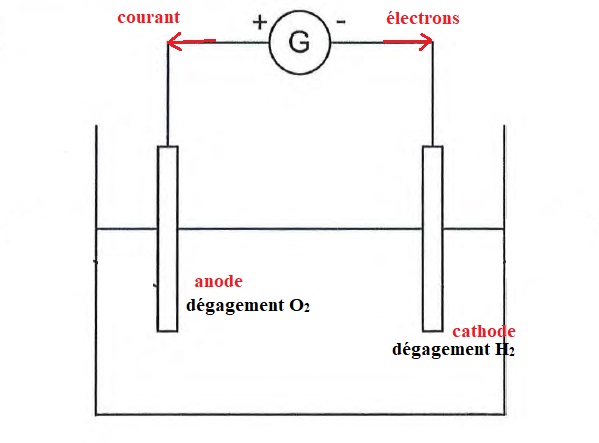
8.2.3 Compléter le schéma en indiquant :
le sens du courant ;
le sens de circulation des électrons ;
l'électrode où se dégage 02 ;
l'électrode où se dégage H2 .
8.2.4 On
veut déterminer l'intensité, I, du courant qui doit circuler dans
l'électrolyseur pour assurer une production de dihydrogène de 10 m3.h-1, soit une quantité de
dihydrogène formée de 417 mol par heure.
8.2.4.a D'après la demi-équation demandée à la question 8.2.2.a, quel est le nombre de moles d'électrons, ne (en mol), échangés pendant cette durée ?
ne = 2 x417 = 834 mol par heure.
8.2.4.b En déduire le nombre d'électrons, Ne, correspondant.
Une mole d'électrons contient 6,02 x 1023 électrons.
Ne = 834 x 6,02 1023 = 5,02 1026 électrons.
8.2.4.c Sachant que la charge transportée par un électron est notée q0, donner la relation entre le nombre d'électrons, N0 , mis en jeu et la charge totale, Q, transportée.
Q = N0 q0.
8.2.4.d Connaissant la charge d'un électron qe = -1,6 X 10-19 C, quelle est l'intensité du courant, I, dans l'électrolyseur pour assurer une production de dihydrogène de
10 m3.h·1 ?
Q = 1,6 10-19 x5,02 1026 = 8,03 107 C.
I = Q / t = 8,03 107 / 3600 =2,2 104 A.
8 .3 Stockage du dihydrogène.
L'électrolyseur fournit 10 m3 de dihydrogène (à la pression de 1 ,0 bar) par heure.
B.3.1. Pour le gaz utilisé dans les conditions de réalisation, on sait que p x V= constante.
Ceci signifie que, pour deux états différents, on peut écrire : p1 x V1 = p2 x V2
Le gaz est stocké dans un volume de 12 m3 et sous une pression de 200 bar. Quel est le volume, V, correspondant à la pression de 1,0 bar?
On donne 1 bar= 105 Pa.
V = 200 x12 / 10= 240 m3.
8.3.2. Combien de temps devra fonctionner l'électrolyseur pour remplir le réservoir de dihydrogène ?
240 / 10 = 24 heures.
8.3.3. Le volume d'une mole de gaz, appelé volume molaire Vm, dépend des conditions de pression et de température.
Pour une pression de 1,0 bar et une température de 16 °C, le volume molaire d'un gaz, Vm , est de 24 L./ mol.
À l'aide d'une analyse dimensionnelle, donner la relation entre V, Vm et n.
En déduire la quantité de matière stockée, n, de dihydrogène.
(n quantité de matière de dihydrogène contenu dans le réservoir).
V est en litre ; n en mol et Vm en mol / litre, d'où V = n Vm.
n = 240 x 103 / 24 = 1,0 104 mol.
8.3.5. Les deux pictogrammes ci-dessous apparaissent sur le réservoir de dihydrogène.
Quelles sont leurs significations ? Quelle(s) conduite(s) doit-on adopter?

Tenir hors de portée des comburants et des feux ; éviter les chocs.
|
....
|
PARTIE C - LA PRODUCTION D'ÉLECTRICITÉ
Quand l'énergie électrique demandée par les consommateurs est supérieure à celle produite par les éoliennes, elle peut être fournie par une pile à combustible à hydrogène ou par un groupe électrogène à combustion de dihydrogène.
C.1 Les piles à combustible à dihydrogène fonctionnent sur le principe inverse à celui de
l'électrolyse selon l'équation: 2 H2(g) + O2(g) = 2H2O (l).,
Cette transformation produit un courant qui circule à l'extérieur de la pile.
C.1.1 Compléter le schéma d'une cellule de pile à combustible en précisant le lieu de l'oxydation et celui de la réduction. Faire
également apparaitre le sens de déplacement des électrons et celui du courant.
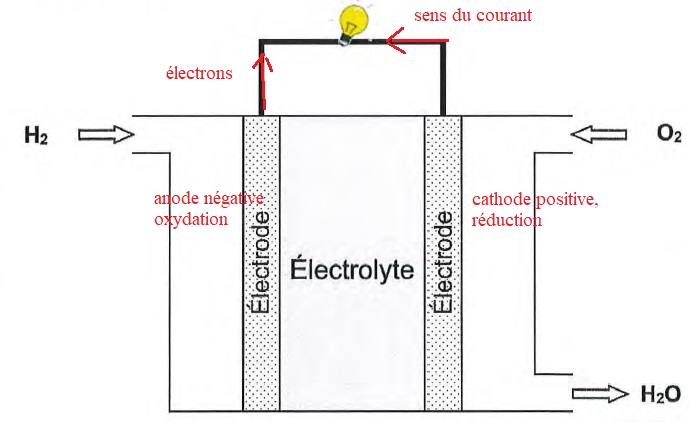
C.1.2 On parle de pile à combustible, dans cette expression, quelle espèce joue le rôle de combustible ?
Le dihydrogène joue le rôle de combustible.
C.1.3 La pile à combustible produit-elle des produits polluants pour l'environnement ? Justifier.
La pile à combustible ne rejette que de l'eau. Elle n'est pas polluante.
C.1.4 On souhaite obtenir aux bornes de la pile, une tension d'une dizaine de volts. Comment doit-on associer les cellules élémentaires sachant que la tension aux bornes d'une cellule est d'environ 0, 7 V ?
10 / 0,7 ~14. Associer 14 cellules élémentaires en série.
C.1.5 Pendant combien de temps peut-on faire fonctionner une cellule en fournissant un courant d'intensité I = 200 A lorsqu'on dispose de 417 moles de dihydrogène?
Données :
Q =ne x F; F, constante de Faraday: F = 9,65 x 104 C.mol·1 ; ne, quantité de matière d'électrons (en mol).
t = Q / I = 417 x9,65 104 / 200 = 2,0 105 s environ 56 heures.
C.2 Groupe électrogène.
Le groupe électrogène sert à produire de l'énergie électrique à partir de la combustion du dihydrogène selon l'équation suivante :
2 H2(g) + O2(g) = 2H2O (l).,
Il possède un rendement h = 30 % et une puissance utile de 55 kW.
On cherche la quantité de dihydrogène nécessaire pour produire 55 kW pendant 2,0 h.
C.2.1 Quelle puissance est absorbée par le groupe électrogène pour produire 55 kW?
55 / 0,30 = 183,3 ~1,8 102 kW.
C.2.2 En déduire l'énergie absorbée nécessaire par le groupe électrogène pendant 2,0 h.
Exprimer le résultat en Joules (rappel : 1 ,0 W.h = 3 600 J).
183,3 x2 = 366,7 kWh = 366,7 x3,6 106 ~1,3 109 J.
C.2.3 Sachant que le dihydrogène possède une enthalpie de combustion
DHc = - 286 kJ / mol , quelle quantité de matière de dihydrogène sera alors nécessaire pour fournir cette énergie ?
1,3 109 / (286 103) ~4,6 103 mol.
|
|





