L'huile
essentielle d'anis étoilé, Bac S Amérique du Nord 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
Cette huile essentielle contient 80 à 90 % en masse d'anéthol. Elle contient en faible quantité un autre isomère, l'estragol.
Le symbole Ar symbolyse un cycle aromatique C6H5.
A. Les molécules d'anéthol et destragol.
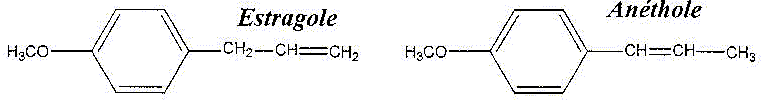
1.1. Ce sont deux isomères. Justifier.
Ils possèdent la même formule brute C10H12O et des formules semi-développées spatiales différentes.
1.2. Lequel présente des stéréoisomères de configuration ? Les représenter.
1.3 Quelle relation de stéréoisomérie lie ces stéréoisomères ?
L'athénole comporte une double liaison carbone carbone avec
des groupes différents sur chaque carbone : il présente la
diastéréoisomérie Z-E
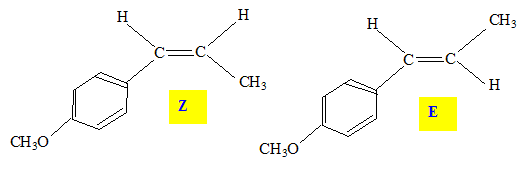
1.4. Peut-on différencier facilement ces deux stéréoisomères au laboratoire ? Justifier.
Non, les molécules sont quasiment identiques.
2. Extraction et analyse de l'anéthol issu de l'anis étoilé.
50,0
g d'anis étoilé sont écrasés. Sous la hotte, mettre le solide obtenu
dans un erlenmeyer et ajouter 200 mL de dichlorométhane. Boucher et
agiter durant 30 minutes. Filtrer. Transvaser le filtrat dans une
ampoule à décanter contenant 200 mL d'eau distillée. Agiter, laisser
décanter. Récupérer la phase contenant l'anéthol. Ajouter 2 à 3 pointes
de spatule de sulfate de sodium anhydre. Filtrer et évaporer le solvant
sous pression réduite. Peser.
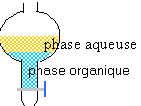
2.1.Schématiser l'ampoule à décanter et identifier les différentes phases.
Dans l'ampoule à décanter les liquides non
miscibles se séparent. Le plus dense occupe la partie inférieure ( dans
ce cas la phase organique : dichlorométhane contenant l'estragole)
2.2. Quelles précautions doit-on prendre pendant cette expérience ? Expliquer.
Le dichlorométhane est cancèrogène. Port de blouse, gants et travail sous hotte aspirante.
2.3.. Sur quels critères est chosi le solvant d'extraction ?
Ce solvant ne doit pas être miscible à l'eau.
L'anéthol doit être très soluble dans ce solvant et très peu soluble dans l'eau.
2.4 Quel est le rôle du sulfate de sodium anhydre ?
Le sulfate de sodium anhydre élimine les traces d'eau présentes dans la phase organique.
|
|
|
|
|
2.5.
On dispose au laboratoire d'un échantillon d'anéthol pur. Proposer une
technique d'analyse pour s'assurer de la présence d'anéthol dans le
filtrat et indiquer les résultats attendus si l'anéthol est bien
présent dans le filtrat.
Chromatographie sur couche mince.
Sur une plaque de silice sensible au rayonnement ultra-violet,
on effectue les dépôts d'anéthol pur ( référence ) et du filtrat. L'éluant est un
mélange de cyclohexane à 97,5% d'acétate d'éthyle à 2,5% en volume. La
plaque est révélée avec une lampe émettant des radiations
ultraviolettes.
Lorsque le chromatogramme d'une essence comporte
une tâche à la même hauteur que celle d'un corps pur (même rapport
frontal), c'est que l'essence contient ce corps pur.
2.6
A partir de 50,0 g d'anis étoilé, on récupère 1,90 mL d'huile
essentielle. L'anéthol est le principal constituant de cette huile. En
négligeant les autres composés, déterminer le pourcentage massique de
l'anéthol dans l'anis étoilé. Commenter.
Masse volumique de l'anéthol : 0,9882 g / mL.
Masse d'anéthol : 0,9882 x 1,90 = 1,87758 g.
Pourcentage massique d'anéthol dans l'anis : 1,87758 / 50,0 x 100 ~3,76 %.
Cela est inférieur au pourcentage massique du texte introductif.
" L'hydrodistillation de l'anis étoilé sec produit 8 à 9 % en masse
d'huile essentielle. Cette huile contient 80 à 90 % en masse d'anéthol.
3. Synthèse de l'anéthol.
L'action
d'un réactif A sur le phénol Ph-OH, en présence d'hydroxyde de sodium,
conduit à la formation de méthoxybenzène ( ou anisole ) selon le schéma
réactionnel ci-dessous :
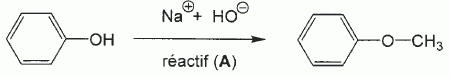
3.1 Quel est le rôle des ions hydroxyde ? En déduire la nature de la réaction mise en jeu.
Réaction acide base : échange de proton entre le phénol ArOH jouant le rôle d'acide et la base ion hydroxyde.
3.2. Compléter le schéma suivant en précisant le site donneur, le site accepteur, les flèches courbes..
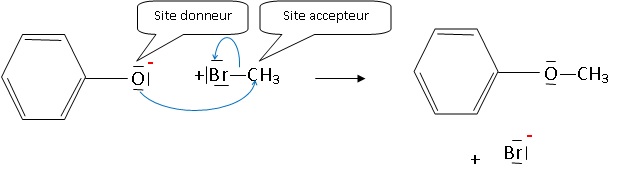
Les flèches courbes indiquent le déplacement des doublets d'électrons.
3.3.. Le produit final est analysé par sprctroscopie RMN du proton.
Le spectre comporte les signaux suivants :
Singulet intégrant pour trois protons à 3,8 ppm.
Doublet intégrant pour 3 H vers 1,9 ppm.
Massif intégrant pour 3 H du cycle aromatique vers 7 ppm.
Multiplet intégrant pour 1 H vers 5,5 ppm.
Multiplet intégrant pour 1H vers 6 ppm.
Ce spectre confirme t-il la présence ou non d'anéthol dans le produit final ?
Singulet intégrant pour trois protons à 3,8 ppm. - O-CH3.
Doublet intégrant pour 3 H vers 1,9 ppm. CH=CH--CH3.
Multiplet intégrant pour 1 H vers 5,5 ppm. CH=CH--CH3.
Multiplet intégrant pour 1H vers 6 ppm. CH=CH--CH3.
Ce spectre confirme la présence d'anéthol.
|
|
4. Vérification du pourcentage massique d'anéthol dans une boisson anisée alcoolisée.
L'étiquette indique : anéthol 0,2 % en masse.
La densité de cette boisson est d = 1 à 25°C.
On réalise un dosage par étalonnage en préparant dans des fioles
jaugées de 50,0 mL une gamme de 5 solutions d'anéthol de concentrations
molaires différentes, à partir d'une solution d'anéthol ( An)
dans l'éthanol, à la concentration de 0,132 mol /L.
La boisson est diluée 50 fois et la solution diluée est notée S.
On mesure l'absorbance de la gamme étalon et de la solution S, à une longueur d'onde de 260 nm.
4.1. A quel domaine de rayonnement électromagnétique cela correspond-il ?
Domaine UV..
4.2 Justifier en analysant la structure de l'anéthol que ce maximum d'absorption correspond à cette gamme de longueur d'onde.
La molécule présente une alternance de 4 double liaison C=C et de
liaison simple C-C. La conjugaison s'étend sur 4 doubles liaisons C=C.
Une molécule ( le benzène) possède trois doubles liaisons conjuguées et présente un maximum d'absorption vers 250 nm.
Lorsque le nombre de liaisons conjuguées croît, le maximum d'absorption se déplace vers les grandes longueurs d'onde.
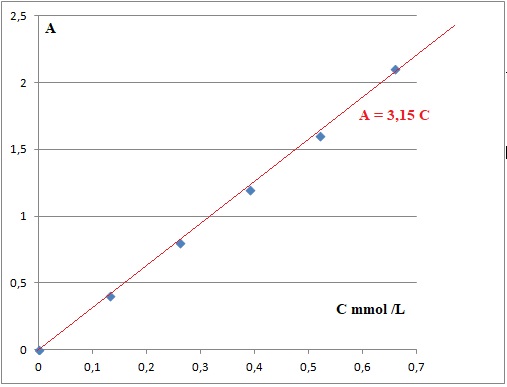
La solution S présente une absorbance AS = 0,80.
0.80 /3,15 = 0,254 mmol/L.
Tenir compte de la dilution : C= 0,254 x50 = 12,7 mmol/L = 0,0127 mmol/L
Masse molaire de l'anéthol : 148 g/mol.
Masse d'anéthol dans 1 L ( 1 kg ) de boisson : 0,0127 x148 = 1,88 g.
Pourcentage massique d'anéthol : 1,88 / 1000 x100 ~ 0,19 %.
L'indication de l'étiquette est correcte, l'écart relatif étant de : (0,2-0,19) / 0,2 =0,05 ( 5 %). .
|
|