Le
Calix-Dans4, un ligand pour la détection des cations polluants, Capes
physique chimie
2016.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
1. Complexation des ions plomb par le Calix-Dans4.
Ces études de complexation ont été menées dans une solution aqueuse (S) contenant :
- de la lutidine ( Lut) est des ions lutidinium LuH+ en concentration apportées respectives [Lut]0 = 5,0 10-3 mol / L et [LutH+]0 =0,14 mol / L.
- des ions Pb2+ à la concentration apportée [Pb2+]0 = C0 = 1,0 10-4 mol / L
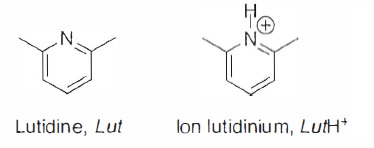
Il a été vérifié expérimentalement que la lutidine, dont l'atome
d'azote est emcombré par deux groupes méthyle portés par les atomes de
carbone voisins, ne complexe pas les ions plomb dans ces conditions et
que l'ion lutidinium n'est pas complexé par le Cadix-Dans4 et n'a aucun
impact sur ses propriétés photophysiques.
27. Estimer le pH de la solution aqueuse (S). En déduire que dans cette solution, l'hydroxyde de plomb Pb(OH)2 ( pKs = 15,7) ne précipite pas.
pKa(LutH+ / Lut) = 6,7.
pH = 6,7 + log ( [LutH+]0/ [Lut]0 ) = 6,7 + log(5,0 10-3/0,14) =5,25 ~5,3.
[HO- ] = 10-14 / 10-5,7 = 5,0 10-9 mol/L.
[Pb2+]0[HO-]2 = 1,0 10-4 x 25 10-18 = 2,5 10-23, valeur inférieure à 10-15,7.
L'hydroxyde de plomb ne précipite pas.
Les ions plomb peuvent aussi à priori former des complexes avec n ions hydroxyde selon les réactions d'équations globales :
Pb2+ aq + n HO- aq = Pb(OH)n2-naq.
On est la constante d'équilibre associée à chaque réaction.
A 298 K, log ß1 = 6,2, log ß2 =10,3, log ß3 =13,3.
Pour n =2, on considère ici l'hydroxyde de plomb sous forme soluble.
28. En supposant qu'il ne se forme aucun précipité, exprimer la concentration totale C0 en plomb en fonction de ß1, ß2, ß3, Ke, et des concentrations à l'équilibre [Pb2+]éq et [H3O+]éq.
C0 = [Pb2+]éq +[Pb(OH)+] +[Pb(OH)2] +[Pb(OH)3-].
ß1 = [Pb(OH)+] / ( [Pb2+][HO- ]) ; ß2 = [Pb(OH)2] / ([Pb2+][HO- ]2).
ß3 = [Pb(OH)3-] / ([Pb2+][HO- ]3).
C0 = [Pb2+] ( 1+ß1 [HO- ] +ß2 [HO- ]2 +ß3 [HO- ]3 ).
En posant [H3O+] = h : C0 = [Pb2+] ( 1+ß1 Ke / h +ß2 [Ke / h ]2 +ß3 [Ke / h ]3 ).
29. En déduire que pour la valeur de pH déterminée à la question 27, le plomb est très majoritairement sous forme non complexé Pb2+.
ß1 Ke / h=106,2 x10-14 / 10-5,3 = 10-2,5 ~0,003<< 1.
ß2 [Ke / h ]2 =1010.3x(10-14 /10-5,3)2 = 10-7,1 << 1.
ß3[Ke / h ]3 =1013.3x(10-14 /10-5,3)3 = 10-12,8 << 1.
[Pb2+] ~ C0 / (1+0,003) ~0,997 C0.
On étudie alors la complexation des ions plomb par le Cadix-Dans4 qui sera noté L par la suite.
Pb2+aq + L aq = PbL2+aq ; ßPb = 1,0 1010.
30. Quels sont les sites du Cadix-Dans4 susceptibles de complexer l'ion plomb ?
La partie centrale située entre les 4 doublets non liants des atomes d'azote des groupes sulfoamide.
31. Calculer la concentration résiduelle en ion Pb2+ libres à l'équilibre après l'ajout de Cadix-Dans4 à la concentration apportée [L]0 = C0 dans la solution (S).
ßPb = [PbL2+] / ([L][Pb2+]).
[PbL2+] = c0-x ; [Pb2+] = [L] = x.
ßPb = (C0-x) / x2 ~ C0 / x2 . x ~(C0 / ßPb)½ =(10-4 / 1010)½ = 10-7 mol/L.
|
...
|
|
Les ions sodium et calcium peuvent être complexés par le Calix-Dans4 :
Na+aq + L aq = NaL+aq ; ßNa = 7,9 104.
Ca2+aq + L aq = CaL2+aq ; ßCa = 2,5 107.
La sélectivité de la complexation des ions plomb par le ligand
Calix-Dans4 en présence d'autres cations comme les ions sodium ou
calcium a été étudiée.
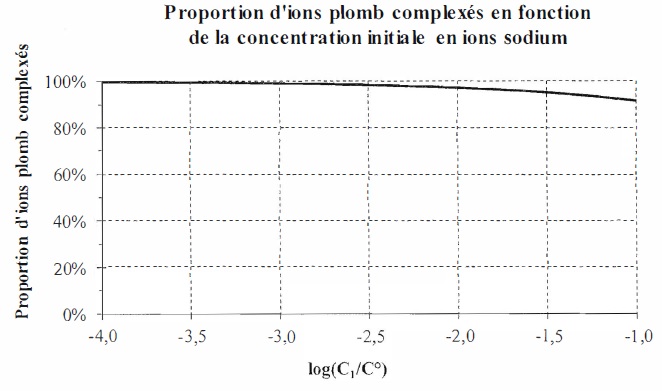
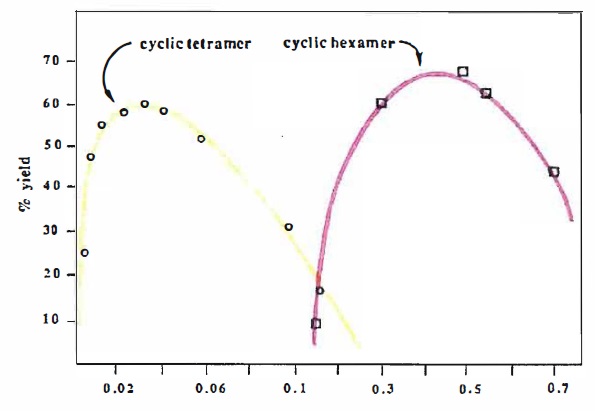
Cas des ions sodium.
On ajoute à la solution (S) du Calix-Dans4 à la concentration apportée C0 et des ions Na+ à la concentration apportée C1 variable entre 1,0 10-4 et 1,0 10-1
mol/L. La figure suivante représente l'évolution de la proportion d'ion
plomb complexés dans le mélange ainsi obtenu en fonction de la
concentration C1 apportée en ion sodium.
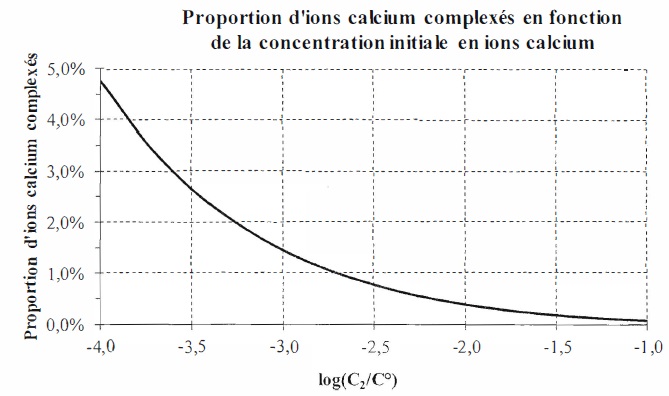
Cas des ions calcium.
On ajoute à la solution (S) du Calix-Dans4 à la concentration apportée C0 et des ions Ca2+ à la concentration apportée C2 variable entre 1,0 10-4 et 1,0 10-1
mol/L. La figure suivante représente l'évolution de la proportion d'ion
plomb complexés dans le mélange ainsi obtenu en fonction de la
concentration C2 apportée en ion calcium.
35. En
comparant les proportions d'ion plomb complexés en présence d'ion
sodium ou d'ions calcium, conclure quant à la sélectivité du ligand
Calix-Dans4 pour la complexation des ions plomb en présence d'ions
sodium ou d'ion calcium dans une eau minérale riche en l'un de ces ions
Même
aux concentrations élevées en ion sodium, le ligand Calix-Dans4 réagit
de préférence, sélectivement, avec les ions plomb. La proportion
d'ions plomb complexés reste supérieure = 90 %.
Les ions calcium ont, comme les ions plomb, une charge égale à 2e. De plus l'ion calcium est plus petit que l'ion plomb.
Lorsque la concentration en ion calcium est faible ou égale à celle des ions plomb, les ions calcium sont peu complexés ( ~5 %).
Par contre lorsque le concentration en ion calcium est bien supérieure à celle des ions plomb :
- pour [C2]0 = 0,10 mol/L, la concentration en ions calcium complexés est égale à 0,1 % soit 0,001 x0,1 = 1,0 10-4 mol/L.
La totalité du ligand complexe les ions calcium. Le ligand n'est plus sélectif pour les ions plomb.
|
....
|
2. Synthèse du p-tert-butylcalix[4]arène.
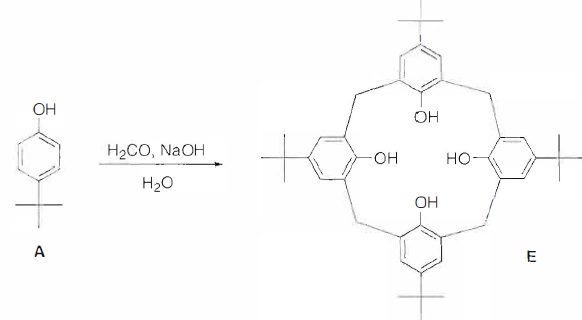
La proportion de soude par rapport au p-tert-butylphénol détermine le nombre d'unités qui forment la structure cyclique.
Rendement de la synthèse d'un tétramère cyclique ( calix[4]arène )en
jaune et d'un hexamère cyclique ( calix[6]arène ) en rose en fonction
du rapport de la quantité de soude à celle du-tert-butylphénol.
On donne un extrait du protocole :
Un mélange de 100 g de p-tert-butylphénol, 62 mL d'une solution de
formaldehyde ( méthanal ) à 3% et 1,2 g d'hydroxyde de sodium dilué
dans 3 mL d'eau est introduit dans un ballon tricol de 3 L équipé d'un
agitateur magnétique..
33. Vérifier que les proportions du protocole permettent d'obtenir majoritairement le tétramère ( rendement voisin de 55 %).
M(tert-butylphénol C10 H14 O) =120 +14 +16 = 150 g/mol.
Quantité de matière de tert-butylphénol : 100 / 150 = 0,67 mol.
Quantité de matière de soude : 1,2 / 40 = 0,03 mol.
0,03 / 0,67 ~0,045. On obtient majoritairement le tétramère.
On se propose d'étudier quelques étapes de la transformation conduisant
au p-tert-butylcalix[4)arène E à patir de A et de méthanal en milieu
basique. Les premières étapes de cette transformation coeerspondent au
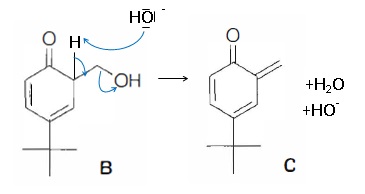
passage par les molécules B puis C ( o-méthylènequinone) :
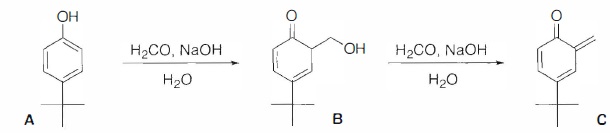
34. Proposer un mécanisme permettant d'expliquer la formation de B à partir de A.
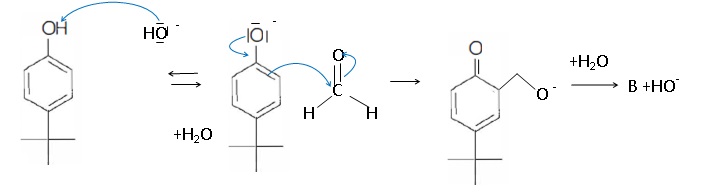
35. Proposer un mécanisme permettant d'expliquer le passage de B à C dans les mêmes conditions opératoires.
C réagit ensuite avec un ion p-tert-butylphénolate pour conduire au dimère D.
36. Proposer un mécanisme permettant d'expliquer la formation de D.
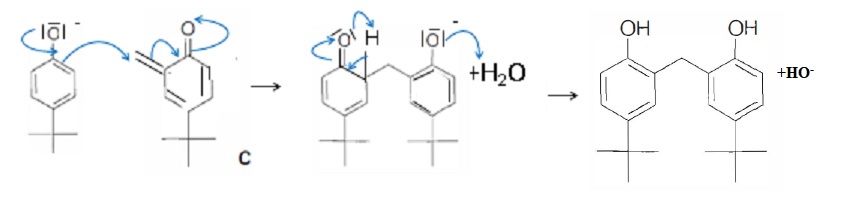
Ce dimère réagit à nouveau avec le méthanal en milieu basique aqueux
pour conduire au trière linéaire et enfin au tétramère cyclique, le
p-tert-butylcalix[4]arène E.
En
solution, les calix[4]arènes sont flexibles d'un point de vue
conformationnel. Le passage intra-annulaire des groupes OH, autorisée
par la flexibilité des ponts CH2 reliant les 4 noyaux phénoliques
permet à ces molécules d'adopter 4 conformations limites, appelées
cône, cône partiel, 1,3-alternée et 1,2-alternée.
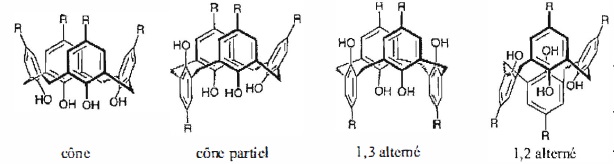
37. Proposer une explication pour justifier que la conformation cône correspond à la conformation privilégiée thermodynamiquement.
Les quatre groupes hydroxyles forment entre elles des liaisons hydrogène. Ces liaisons privilégient cette conformation.
|
.3. Synthèse du Calix-Dans4.
Dans le but de simplifier l'écriture des composés cycliques mis en jeu,
la suite de la synthèse du Calix-Dans4 sera présentée en ne faisant
apparaître qu'une seule unité phénolique du calixarène, à la manière
d'un polymère, sachant que les réactions envisagées s'appliquent
évidemment aux autres unités phénoliques présentes.
Ainsi le p-ter-butylcalix[4]arène E pourra être représenté de la manière suivante.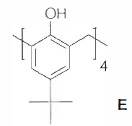
On se propose d'étudier la synthèse en 4 étapes du Calix-Dans4 L
à partir de E en utilisant le bromoacétate d'éthyle F, le chlorure
d'oxalyle I et le dansylamide K.
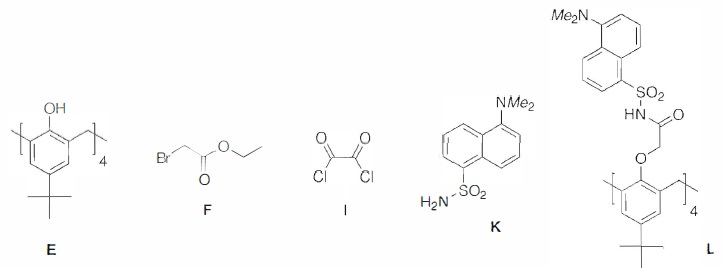
Première étape
: 3,6 g ( 4,6 mmol) de p-tert-butylcalix[4]arène E sont ajoutés à une
suspension de 4,0 g d'hydrure de sodium à 60% dans l'huile de parafine
( 100 mmol) dans 20 mL de DMF et 80 mL de THF anhydres, puis laissés
agiter à température ambiante. Après introduction de 8,8 mL ( 79,6
mmol) de bromoacétate d'éthyle F, le système est porté à reflux 24
heures. L'excès d'hydrure de sodium est neutralisé à l'éthanol, les
solvants sont évaporés sous pression réduite et du dichlorométhane
ajouté au résidu. Le mélange est lavé avec une solution aqueuse d'acide
chlorhydrique à 10 % et à l'eau distillée. Les extraits organiques sont
séchés sur sulfate de magnésium anhydre puis concentrés sur évaporateur
rotatif. La masse m de produit G est obtenue par recristallisation dans
le méthanol sous forme d'un solide blanc.
38. Expliquer la "neutralisation de l'hydrure de sodium par l'éthanol " à l'aide d'une équation de réaction.
C2H5OH + NaH ---> C2H5O- + Na+ + H2(g).
39. Donner la formule topologique du produit G ( de masse molaire M(G) = 992 g / mol).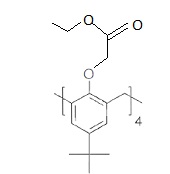
40. Calculer la masse m de produit G qui a été obtenu sachant que le rendement de cette première étape est de 91 %.
Les coefficients stoechiométriques de la réaction donnent : n(G) = n(E) x0,91 = 4,6 x0,91 = 4,186 mol.
m = 4,186 10-3 x 992 = 4,15 ~4,2 g.
Deuxième étape
: dans l'éthanol, G est mis à réagir avec une solution aqueuse de soude
à 15 %. le mélange est agité à température ambiante, puis porté à
reflux. Les solvants sont éliminés à l'évaporateur rotatif. Le résidu
est traité par l'acide chlorhydrique à 10 % puis extrait par du
dichlorométhane. La phase organique est séchée sur sulfate de magnésium
anhydre et évaporée sous pression réduite. Le résidu est recristallisé
dans le cyclohexane pour fournir un solide blanc H avec 76 % de
rendement.
41. Nommer la réaction qui a lieu entre le composé G et la solution aqueuse de soude.
Saponification ou hydrolyse basique de l'ester.
42. Donner la formule du produit H.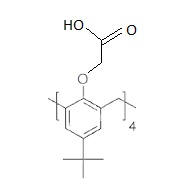
Troisième et quatrième étapes.
Traité par le chlorure d'oxalyle I, le composé H ( C52H64O12)conduit au produit J ( C52H60Cl4O8).
J réagit alors avec le dansyamide K en présence d'hydrure de sodium
pour conduire à L, solide jaune, avec un rendement de 69 %.
43. Donner la formule topologique de J.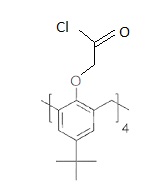
44. Calculer le rendement global de cette synthèse.
0,91 x0,76 x0,69 ~0,48 ( 48 %).
|
|
|















