Chimie,
Concours TSPEI 2017.
Technicien supérieur principal de l'économie et de l'industrie.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
Préparation industrielle de la chaux.
La chaux CaO(s) est le constituant essentiel du ciment. On porte à haute température une masse m1 =800 kg de calcaire CaCO3(s) qui se décompose en donnant de la chaux et du dioxyde de carbone.
1.a. Donner la configuration électronique des atomes de carbone, d'oxygène et de calcium.
C : 1s2 2s2 2p2 ; O : 1s2 2s2 2p4 ; Ca : 1s2 2s2 2p6 3s2 3p6 4s2.
1.b. Donner la structure de Lewis de la molécule de dioxyde de carbone. Indiquer sa géométrie.
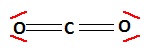 Molécule linéaire. Molécule linéaire.
1.d. Le carbonate de calcium est formé d'ion calcium et d'ion carbonate. Donner la formule de ces ions.
Le solide étant électriquement neutre : Ca2+ et CO32-.
2.a. Ecrire l'équation de décomposition du calcaire.
CaCO3(s) ---> CaO(s) + CO2(g).
2.b. Déterminer la quantité de matière initiale de calcaire.
M calcaire = 40 +12 +3 x16 = 100 g / mol.
ni = m1 / Mcalcaire = 800 103 / 100 = 8,0 103 mol.
2.c. Déterminer la masse de chaux préparée et le volume de CO2 produit.
Mchaux = 40 +16 = 56 g/mol.
nchaux = 8,0 103 mol
Masse de chaux : 56 x8,0 103 = 4,48 105 g = 448 kg.
Quantité de matière de dioxyde de carbone : 8,0 103 mol
Volume molaire des gaz : 24 L /mol.
Volume de dioxyde de carbone : 24 x8,0 103 = 1,92 105 L ou 192 m3.
|
|
|
Analyse d'un pesticide.
Il contient de l'arsenic sous la forme As4O6(s). On prélève un échantillon de masse m = 40,52 g. Un traitement chimique transforme la totalité de As4O6(s) en ion arséniate AsO43-
aq. On ajoute à la solution obtenue une solution de nitrate d'argent de
concentration c = 0,456 mol/L. Il se forme un précipité d'arséniate
d'argent. Un volume minimal V =38,6 mL de solution de nitrate d'argent
est nécessaire pour faire réagir la totalité des ions arséniates.
1. Ecrire l'équation chimique relative à cette réaction.
AsO43- aq +3Ag+aq ---> Ag3AsO4(s).
On choisit 3 hommes parmi 6 et 3 femmes parmi 4 :
2. On suit le titrage par conductimétrie. Annoter le schéma du dispositif.
Comment repère t-on l'équivalence ?
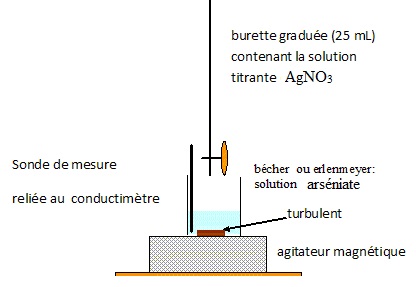
La courbe obtenue est constituée de deux segments de droite.
L'équivalence est repérée par l'abscisse de l'intersection des deux segments de droite.
3.
Calculer la quantité initiale d'ion argent nécessaire pour faire réagir
la totalité des ions arséniate. En déduire la quantité d'ions arséniate
dans la solution.
n(Ag+) = V C = 38,6 x 0,456 =17,6 mmol.
n(arséniate) = 17,6 / 3 = 5,867 mmol.
4. En déduire le pourcentage massique de As4O6(s) contenu dans le pesticide.
M(As) = 74,9 g/mol ; M(O) = 16 g/mol.
As4O6(s) conduit à 4 AsO43- aq.
n(As4O6(s))= 5,867 / 4 = 1,4668 mmol.
M(As4O6(s))=4x74,9 +6x16 =395,6 g/mol.
Masse de As4O6(s) :395,6 x1,4668 10-3 =0,58 g.
Pourcentage massique correspondant : 0,58 / 40,52 x100 =1,43 %.
|
|
|
|
Electrolyse du cadmium.
Le cadmium est obtenu par électrolyse d'une solution de sulfate de cadmium Cd2+aq +SO42-aq et d'acide sulfurique. La tension aux bornes de l'électrolyseur est U = 3,1 V et l'intensité du courant I = 2,5 104 A. Les ions sulfate ne participent pas aux transformations chimiques.
1. Ecrire l'équation de la réduction des ions cadmium. Sur quelle électrode se produit-elle ?
A la cathode négative Cd2+aq +2e- ---> Cd(s).
2. Un dégagement gazeux se
produit sur l'autre électrode. Quelle est sa nature ? Justifier. Ecrire
l'équation de la réaction globale d'électrolyse.
Oxydation de l'eau en dioxygène à l'anode : H2O(l) ---> ½O2(g) + 2e- +2H+aq.
Cd2+aq +H2O(l)---> Cd(s) +½O2(g) +2H+aq.
3. Schématiser l'électolyseur en indiquant le sens du déplacement des porteurs de charge.
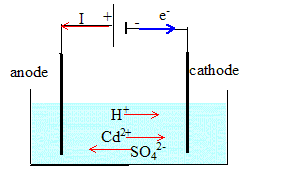
4. Déterminer la quantité d'électricité qui a circulé dans l'électrolyseur en 24 h.
Q = I t = 2,5 104 x24 x3600 =2,16 109 C.
5. En déduire la quantité de matière puis la masse de cadmium obtenu. M(Cd) = 112,4 g/mol.
Quantité de matière d'électron : ne=2,16 109 / 96500 =2,238 104 mol.
Quantité de matière de cadmium : n = 2,238 104 / 2 = 1,119 104 mol.
Masse de cadmium : 1,119 104 x112,4 =1,26 106 g = 1,26 tonnes.
6. On obtient en réalité 1,0 tonne de cadmium. Quel est le rendement ?
1,0 / 1,26 ~0,79 ( 79 %).
|
|
|