Surveillance
de la glycémie,
bac S Centres étrangers 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
1. Le glucose.
Le glucose est un glucide qui fait partie des hexoses. Dans la nature,
le glucose, dans une configuration à chaîne ouverte (non cyclique), se
trouve sous forme de D-glucose dont la représentation de Cram est
donnée ci-dessous.
1.1. La molécule de glucose.
1.1.1. Donner la formule brute du D-glucose.
C6H12O6.
1.1.2. Recopier la
formule du D-glucose ci-dessus, identifier les groupes caractéristiques
de cette molécule et nommer la fonction associée à chacun d’eux.
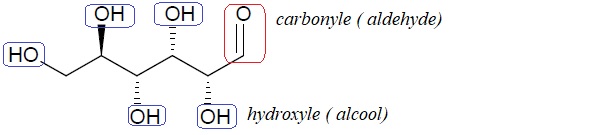
1.2. Stéréoisomérie.
1.2.1. Identifier
sur la représentation de la question précédente les atomes de carbone
asymétriques en les repérant par un astérisque.

1.2.2. Représenter le L-glucose, énantiomère du D-glucose.
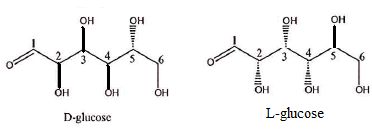 1.2.3. Représenter un diastéréoisomère du D-glucose.
1.2.3. Représenter un diastéréoisomère du D-glucose.
Il suffit d'inverser la configuration de l'un des atomes de carbone asymétriques.
2. Étude d’une réaction permettant le dosage du glucose.
En laboratoire d’analyse médicale, on utilise deux réactions enzymatiques pour déterminer le taux de glucose dans le sang.
Dans un premier temps, en présence de glucose-oxydase, le glucose est
oxydé par le dioxygène dissous en acide gluconique avec formation de
peroxyded’hydrogène H2O2. L’équation de cette réaction, notée par la suite (1), est la
suivante :
Glucose(aq) + O2 (aq) + H2O(l) → C6H12O7(aq) + H2O2(aq) (1)
Dans un second temps, en présence d’une seconde enzyme, la peroxydase,
le peroxyde d’hydrogène formé par la réaction (1) est dosé selon la
réaction (2) cidessous:
2 H2O2 + phénol + amino-4-antipyrine → quinonéimine + 4 H2O (2)
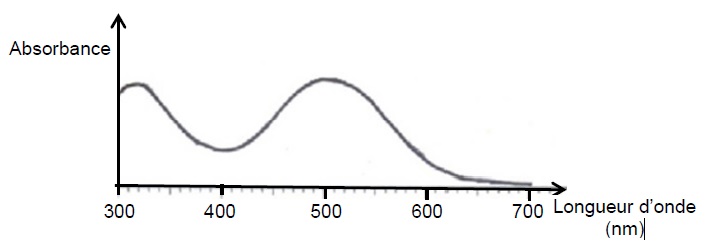
Spectre d’absorption de la quinonéimine.
2.1. Donner le rôle d’une enzyme.
Une enzyme joue le rôle de catalyseur.
2.2. Au
laboratoire, différents sucres sont mis en présence de glucose-oxydase.
On suit l’évolution de la concentration en dioxygène au cours du temps
dans le milieu réactionnel. On obtient les courbes ci-dessous :
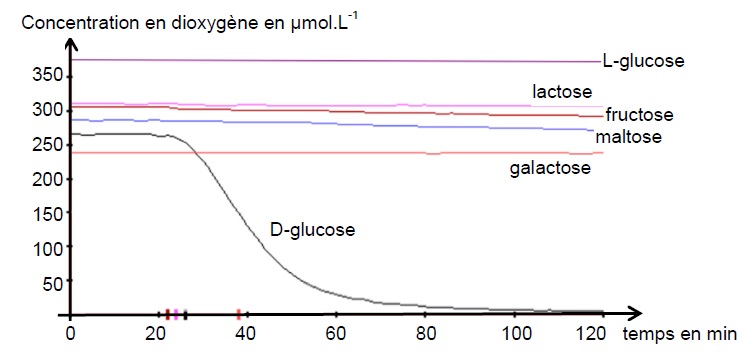
D’après http://www2.ac-lyon.fr/
Commenter ces courbes et indiquer la propriété de la glucose-oxydase ainsi mise en évidence.
Pour les autres sucres que le glucose, la concentration en dioxygène reste constante.
Seul le glucose est oxydé par le dioxygène dissous en acide gluconique en présence de glucose-oxydase,
La glucose-oxydase est stéréosélective.
|
|
|
.
2.3.
Lorsque la réaction (2) est terminée, on mesure l’absorbance de la
solution à l’aide d’un spectrophotomètre pour déterminer la
concentration en quinonéimine.
2.3.1. Sur quelle longueur d’onde du domaine du visible le spectrophotomètre doit-il être réglé ? Justifier.
Pour obtenir le maximum de précision, on travaille à la longueur d'onde
pour laquelle le spectre d'absorption présente un maximum.
( 500 nm dans le domaine visible ).
2.3.2. Pour une personne non-diabétique avec une glycémie maximale à jeun, déterminer la concentration maximale en quinonéimine.
Une personne non-diabétique présente une glycémie à jeun comprise entre 3,5 et 6,1 mmol.L-1.
D'après la réaction (I) , la concentration finale en eau oxygénée est égale à la concentration initiale en glucose.
D'après la réaction (II), la concentration finale en quinonéimine est égale à la moitié de la concentration initiale en eau oxygénée.
Donc 6,1 / 2 ~ 3,0 mmol / L.
2.4.
Les trois courbes ci-dessous donnent l’évolution de l’absorbance de
solutions sièges de la transformation (2) dans différentes conditions
de température, de pH et de concentration enzymatique et à la longueur
d’onde d’étude choisie.
Proposer, en justifiant, des conditions a priori optimales pour réaliser le dosage du glucose en laboratoire d’analyses.
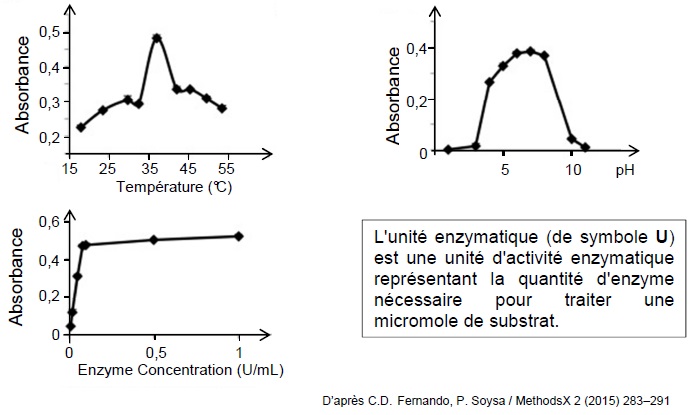
L'absorbance est maximale :
- pour une température comprise entre 35 °C et 40 °C.
- pour un pH compris entre 6 et 9.
- pour une concentration en enzyme supérieure à 0,1 U.
2.5. Pour maintenir le pH constant, on utilise une solution tampon préparée en mélangeant 57,8 mL d’une solution à 1,0 mol.L-1 de dihydrogénophosphate de sodium avec 42,2 mL d’une solution à 1,0 mol.L-1 d’hydrogénophosphate de sodium. On complète à 1,0 L avec de l’eau distillée.
2.5.1. Écrire l’équation de la réaction de l’acide faible dihydrogénophosphate H2PO4- avec l’eau.
H2PO4- aq + H2O(l) = HPO42- aq +H3O+aq.
2.5.2. En admettant que les quantités de matière de H2PO4- et H2PO4- dans le mélange sont égales aux quantités de matière apportées, calculer le pH de la solution tampon ainsi préparée.
pH = pKa( H2PO4- aq / HPO42- aq) + log ([ HPO42- aq ] / [ H2PO4- aq]).
pH = 7,2 + log(42,2 / 57,8) =7,06 ~7,1.
|
|
|
|
3. Dosage du glucose en laboratoire.
Au laboratoire, on mélange 1 mL d’une solution contenant les différents
réactifs et enzymes avec 10 μL de solutions étalons de glucose. Les
mesures d’absorbances réalisées sont regroupées dans le tableau
ci-dessous.
Numéro de la solution
|
1
|
2
|
3
|
4
|
5
|
Concentration en glucose ( g / L)
|
0,20
|
0,40
|
0,60
|
0,80
|
1,0
|
Absorbance
|
0,088
|
0,168
|
0,252
|
0,336
|
0,420
|
3.1. Décrire le
protocole de la préparation de 100,0 mL de la solution n°1 à partir de
la solution n°5 en précisant la verrerie utilisé e. Justifier par un
calcul.
Facteur de dilution F = 1,0 / 0,20 = 5.
Prélever 100 / 5 = 20,0 mL de la solution n°5 à l'aide d'une pipette jaugée.
Placer dans une fiole jaugée de 100,0 mL ; compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter pour rendre homogène.
3.2. En suivant le
protocole du laboratoire décrit à la question 3, l’analyse d’un
prélèvement sanguin sur un patient diabétique à jeun conduit à une
mesure d’absorbance de 0,388.
Déterminer la concentration en glucose dans le sang de ce patient. Commenter le résultat.
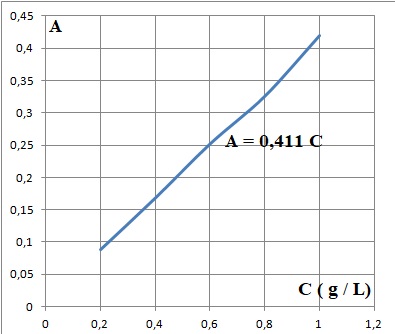
C = 0,388 / 0,411 ~0,94 g / L
M(glucose) = 180 g / mol ; 0,94 / 180 = 5,2 10-3 mol / L = 5,2 mmol / L.
Pour une personne diabétique, les objectifs glycémiques sont fixés entre 4 et 7 mmol.L-1 avant le repas. La glycémie est correcte.
4. Autosurveillance glycémique.
L’autosurveillance consiste à mesurer soi-même sa glycémie. Elle se
révèle indispensable pour de nombreux diabétiques. Elle est réalisée le
plus souvent à partir d’une goutte de sang prélevée à l’extrémité d’un
doigt grâce à un autopiqueur. Cette goutte de sang est ensuite déposée
sur une bandelette ou une électrode qui est insérée dans le lecteur de
glycémie.
Un dispositif d’autosurveillance glycémique respectant la norme NF EN
ISO 15197 affiche une mesure avec une incertitude telle que :
- si la concentration en glucose est strictement inférieure à 1 g/L :
valeur lue +/- 0,15 g/L
- si la concentration en glucose est supérieure ou égale à 1 g/L :
valeur lue +/- 15%
Un diabétique réalise un contrôle de sa glycémie avant un repas et obtient une valeur de 1,07 g.L-1. En tenant compte de l’incertitude liée par la norme, peut-il en déduire si les objectifs glycémiques sont atteints ?
1,07 x 15 /100 = 0,16 g / L soit 1,07 ±0,16 g / L.
La glycémie est comprise entre 0,91 et 1,23 g / L soit entre 5,0 et 6,8 mmol / L.
Les objectifs glycémiques sont atteints.
|
|
|