Composition d'un
bonbon,
bac S Polynésie 2019
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
Sur l'emballage d'un paquet de bonbons, on peut lire l'information
suivante :
Ingrédients : sucre, sirop de glucose, amidon de maïs, humectant :
sirop de sorbitol, farine de blé, acidifiants : E296 et E330, arômes concentrés de fruits
et de plantes (pomme, cassis, radis) ; colorant bleu.
On s'intéresse dans cet exercice à quelques-uns de ces composés et à
leurs propriétés.
1. L’additif alimentaire E296.
L'additif alimentaire E296, introduit comme acidifiant, correspond à l'acide malique dont
la formule semi-développée est représentée.
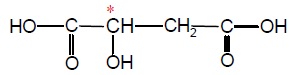
1.1. Cet acide présente-t-il des stéréoisomères de configuration ?
Justifier.
La présence d'un atome de carbone asymétrique conduit à l'existence de deux énantiomères.
L'acide malique est un diacide faible en solution aqueuse. Les pKa des
deux couples
acide/base correspondants sont : pKa1 = 3,5 et pKa2 = 5,1.
1.2. Définir l’expression « acide faible ».
Un acide faible réagit partiellement avec l'eau.
1.3. Pourquoi l’acide malique est-il un « diacide » ?
L'acide malique possède deux fonctions acides carboxylique COOH.
Le diagramme de prédominance incomplet donne la formule brute d'une des trois formes de l’acide malique.
1.4. Sur la copie, indiquer les formules brutes des formes 1 et 3 intervenant dans le diagramme précédent.
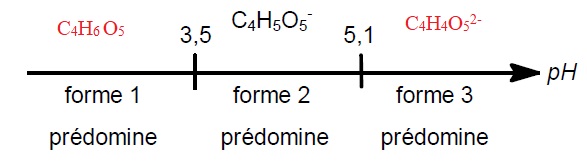
La salive humaine a un pH approximatif compris entre 6,5 et 7,4.
Si on met un bonbon dans la bouche, on éprouve une sensation acide.
1.5. Indiquer la forme prédominante prise par l'acide malique dans la bouche. Proposer une interprétation de la sensation éprouvée.
A un pH compris entre 6,5 et 7,4 la forme 3 prédomine.
|
|
...
.
|
|
|
2. Le colorant bleu.
On souhaite déterminer la nature du colorant bleu entrant dans la
composition du bonbon. Ce colorant est la seule espèce chimique
présente dans le bonbon qui absorbe dans le visible.
Pour obtenir son spectre d'absorption, on réalise tout d'abord une
solution à partir d'un bonbon en mettant en oeuvre le protocole suivant
:
· dans un bécher de 100 mL, introduire 20 mL d'eau distillée et un bonbon bleu ;
· grâce à une plaque chauffante, augmenter la température du mélange et agiter jusqu'à dissolution totale du bonbon ;
· filtrer le mélange pour obtenir une solution limpide ;
· la refroidir à température ambiante, l'introduire dans une fiole
jaugée de 25,0 mL et compléter le niveau jusqu'au trait de jauge avec
de l'eau distillée.
Homogénéiser.
On appelle S la solution ainsi obtenue.
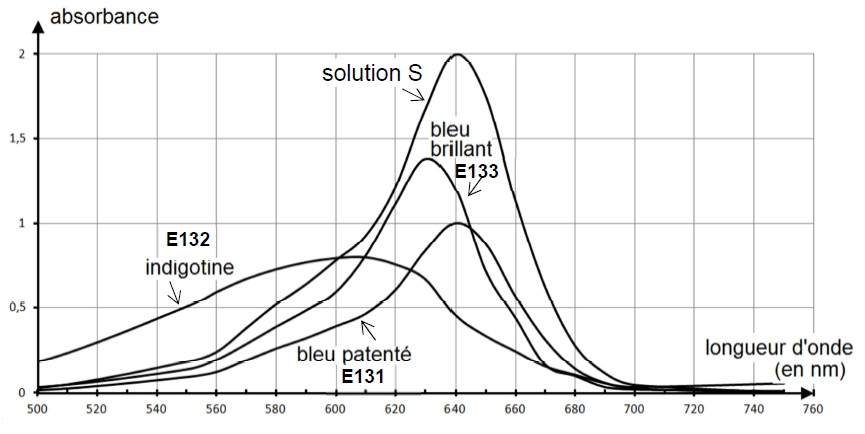
On réalise le spectre d'absorption de cette solution pour le comparer à
ceux de trois solutions de colorants alimentaires connus, de
concentration en colorant
Ccolorant = 1,00 x 10-5 mol.L-1 : le
bleu patenté E131, l'indigotine E132 et le bleu brillant E133. Les
quatre spectres d'absorption obtenus sont représentés ci-dessous.
La loi de Beer-Lambert
indique que pour une longueur d'onde fixée, l'absorbance A d'une espèce
chimique en solution est proportionnelle à sa concentration C.
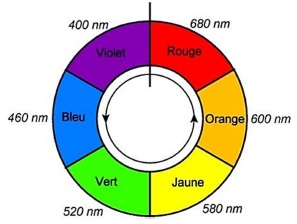
Deux couleurs diamétralement opposées sur le cercle chromatique sont complémentaires.
|
|
|
|
L'Union
européenne fixe, pour tous les colorants alimentaires, les valeurs de
dose journalière admissible (DJA), en mg de produit absorbable par kg
de massecorporelle et par jour.
Colorant
|
E131
|
E132
|
E133
|
DJA mg kg-1 jour-1
|
2,5
|
5,0
|
10,0
|
Masse molaire du colorant g / mol
|
560
|
420
|
747
|
2.1. Le spectre de la solution S est-il cohérent avec la couleur du bonbon ? Justifier.
La solution S et le bleu patenté E131 présentent un maximum
d'absorption à 640 nm ( orange). La solution S et le bleu patenté
possèdent la couleur complémentaire de l'orangé soit le bleu.
Le colorant E132 présente un maximum d'absorption vers 610 nm( orange). Ce colorant possède la couleur complémentaire de l'orangé soit le bleu.
Le colorant E133 présente un maximum d'absorption vers 630 nm( orange). Ce colorant possède la couleur complémentaire de l'orangé soit le bleu.
2.2.
À l'aide de vos connaissances et des informations fournies, déterminer
le nom et la concentration molaire du colorant présent dans la solution
S. Justifier.
La solution S et le bleu patenté E131 présentent un maximum d'absorption à 640 nm ( orange). Il s'agit du colorant E131, bleu patenté.
L'absorbance A d'une espèce chimique en solution est proportionnelle à sa concentration C.
A 640 nm : A131 = k Ccolorant = 1,00 x 10-5 k =1.
AS = k CS = 2.
CS =2 x10-5 mol / L.
2.3.
Déterminer le nombre maximal de bonbons qu'un enfant de 30 kg peut
ingérer chaque jour sans dépasser la DJA du colorant. Commenter le
résultat trouvé.
Quantité de matière de colorant E131 dans un bonbon : 2 10-5 x 0,025 =5,0 10-7 mol.
Masse de colorant dans un bonbon : 5,0 10-7 x 560 = 2,8 10-4 g =0,28 mg.
Un enfant de 30 kg peut ingérer 30 x 2,5 = 75 mg soit 75 / 0,28 = 268 bpnbons par jour.
Cela est peu probable.
|
|
|
|