Valorisation
des déchets,
bac STI2D biotechnologies Polynésie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Partie A : valorisation énergétique des
déchets (8 points)
Le chauffage urbain de la ville de Nîmes fournit de l’eau chaude pour
le chauffage et pour les sanitaires au centre hospitalier universitaire, à plusieurs écoles,
collèges, lycées mais aussi à des habitations de certains quartiers de la ville.
Le 2 mars 2015, la ville de Nîmes a inauguré sa nouvelle chaufferie,
plus économique et plus écologique. Elle est en effet raccordée à l’incinérateur d’ordures
ménagères afin de récupérer l’énergie produite par la combustion des déchets. Cette
énergie couvre 56% des besoins énergétiques du chauffage urbain, les 44% restants étant
obtenus à partir du gaz de ville.
Grâce à cette énergie de récupération, ce sont plus de 16 000 tonnes de
CO2 chaque année qui ne seront pas rejetées dans l’atmosphère.
Le but de cette partie est de déterminer l’énergie récupérée grâce à la
valorisation énergétique des déchets.
A.1 Composition et combustion du gaz de ville.
A.1.1 Le gaz de ville (ou gaz naturel) utilisé par la ville de Nîmes
provient majoritairement de Russie. Donner le nom de
l’alcane composant de manière très majoritaire ce gaz naturel. Par la suite, nous ferons
l’approximation que le
gaz naturel est composé uniquement de cet alcane.
Méthane CH4.
A.1.2 Écrire l’équation de la réaction modélisant la combustion
complète du méthane CH4 dans le dioxygène de l’air O2(g). On rappelle qu’il y a formation de
dioxyde de carbone gazeux CO2(g) et de vapeur d’eau H2O(g).
CH4(g) + 2O2(g) ---> CO2(g) + 2H2O(g).
A.2 Détermination expérimentale du pouvoir calorifique du méthane
Le but de cette partie est de déterminer le pouvoir calorifique du
méthane. Pour cela on réalise l’expérience suivante.
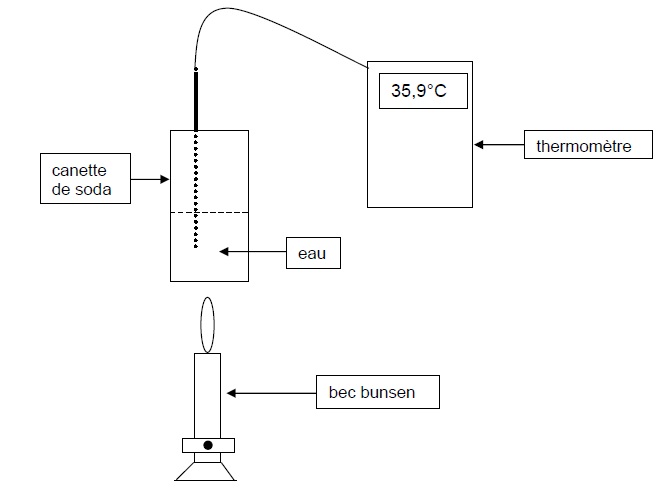
Description de la manipulation : on verse meau = 150 g d’eau froide à la température qi
= 19,2 °C. On chauffe l’eau avec la flamme d’un bec bunsen alimenté par
du gaz de ville pendant une durée d’une minute. La température de l’eau
est alors égale à qf = 35,9 °C.
A.2.1 Détermination de la quantité de matière de méthane brûlée.
A.2.1.1 Le débit volumique du bec Bunsen est QV = 5×10–3 L.s–1.
La manipulation a duré une minute. Quel volume de méthane a été brûlé
durant la manipulation ?
5 10-3 x 60 =0,30 L.
A.2.1.2 Dans les conditions de l’expérience le volume molaire est Vm =
24 L.mol–1.
En déduire la quantité de matière de méthane brûlé.
0,30 / 24 =0,0125 ~0,13 mol.
A.2.2 Détermination de l’énergie libérée.
On fera l’approximation dans cette partie que toute l’énergie libérée
par la combustion du méthane a servi à chauffer l’eau contenue dans la canette.
A.2.2.1 Déterminer l’énergie reçue par l’eau au cours de la manipulation.
On donne la capacité thermique massique de l’eau liquide ceau = 4180 J.kg–1.°C–1.
Q = meau ceau (qf-qi) = 0,150 x 4180 (35,9-19,2)=1,05 104 J.
A.2.2.2 En déduire l’énergie cédée par la combustion du méthane.
-1,05 104 J.
A.2.2.3 Exprimer cette énergie en kWh. On donne : 1 kWh = 3,6×106 J.
-1,05 104 / (3,6 106) = -2,9 10-3 kWh m-3.
A.2.2.4 En déduire la valeur de l’énergie libérée par la combustion de 1 m3 de méthane.
-2,9 10-3 x1000 / 0,30 = -9,7 kwh m-3.
Cette valeur correspond au Pouvoir Calorifique Supérieur (PCS) expérimental.
A.2.2.5 Le PCS fourni est égal à 10,8 kWh.m–3.
Déterminer l’écart relatif :
(10,8-9,7) / 10,,8 x100 ~ 10 %.
A.2.2.6 Proposer deux explications pour justifier l’écart entre la valeur de référence et la valeur expérimentale.
Une partie de l'énergie libérée par la combustion sert à chauffer la canette et l'air extérieur.
Erreur de mesure sur la durée ( une minute).
A.3 Détermination de l’énergie produite par l’incinérateur d’ordures ménagères et récupérée par la nouvelle chaufferie.
La nouvelle chaufferie permet d’économiser 16 000 tonnes de CO2
par rapport à une chaufferie ne consommant que du méthane, car elle
utilise une partie de l’énergie produite par l’incinérateur d’ordures
ménagères situé à proximité.
A.3.1 Calculer la masse molaire de dioxyde de carbone CO2.
M(C) = 12 g.mol–1 et M(O) = 16 g.mol–1.
M(CO2) =12 + 2 x16 = 44 g / mol.
A.3.2 En déduire la quantité de matière n de CO2 correspondant à 16×103 tonnes.
n = 16,109 / 44 ~3,6 108 mol.
A.3.3 Par le raisonnement de votre choix, montrer que cette quantité de matière de CO2 économisée par la récupération de l’énergie produite par l’incinérateur, correspond à une combustion de 3,6×108 mol de méthane.
CH4(g) + 2O2(g) ---> CO2(g) + 2H2O(g).
Au regard des nombres stoechiométriques, la combustion de 3,6 108 mol de méthane conduit à 3,6 108 mol de CO2.
A.3.4 Si le volume molaire est toujours égal à Vm = 24 L.mol–1, à quel volume de méthane cette quantité de matière correspond-elle ? Exprimer le résultat en m3.
3,6 108 x24 =8,7 109 L = 8,7 106 m3.
A.3.5
En considérant le PCS théorique donné, quelle énergie produite par
l’incinérateur d’ordures ménagères en kWh est récupérée par la
chaufferie ?
8,7 106 x10,8= 9,4 107 kWh.
|
...
|
|
Partie B : recyclage des piles et des accumulateurs (6,5 points)
Chaque année, plus de 1,2 million de piles et d’accumulateurs sont mis
sur le marché à destination des ménages et des professionnels français,
ce qui représente une masse de 220 000 tonnes. Cette masse est en
diminution depuis plusieurs années témoignant d’une miniaturisation
croissante. Ces produits peuvent contenir certaines substances
dangereuses pour l’environnement et la santé et présentent par ailleurs
un fort potentiel de
recyclage des matières qui les composent (métaux, plastiques, …). Une
filière spécifique de collecte et de traitement par recyclage de ces
déchets a été instaurée en Europe au début des années 1990.
B.1 Étude des piles alimentant votre calculatrice : la pile AAA-LR03
B1.1 Indiquer quel type de piles il faut utiliser dans votre calculatrice.
PA portable : est considéré comme pile ou accumulateur portable toute
pile, pile bouton, assemblage en batterie ou accumulateur qui est scellé
et susceptible d’être porté à la main.
B.1.2 Quel est le rôle de l’électrode en zinc ? Justifier.
Le zinc joue le rôle d'anode négative. Il s'oxyde en libérant des électrons.
B.1.3 Le couple oxydant / réducteur présent à la borne négative est Zn2+ / Zn. Écrire la demi-équation électronique modélisant l’oxydation du Zinc.
Zn ---> Zn2++2e-.
B.1.4 Le couple oxydant / réducteur présent à la borne positive est MnO2 / MnO(OH).
Écrire la demi-équation électronique modélisant la réduction du dioxyde de manganèse MnO2.
MnO2 + H2O + e- ---> MnO(OH) + HO-.
B.1.5 En déduire l’équation de fonctionnement de cette pile.
Zn ---> Zn2++2e-.
2MnO2 + 2H2O + 2e- ---> 2MnO(OH) + 2HO-.
Ajouter et simplifier.
2MnO2 + 2H2O + Zn ---> 2MnO(OH) + 2HO- +Zn2+.
B.2. Analyse de la fiche technique des piles présentes dans votre calculatrice
B.2.1 L’énergie
disponible W (en joule) d’une pile est égale au produit de sa capacité
disponible Q (en coulomb) par sa tension à vide E (en volt). Montrer
que l’énergie disponible pour cette pile est égale à 2,27×103 J.
On donne : 1 Ah = 3600 C. E = 1,5 V. Q =420 mAh = 0,42 Ah.
W = 1,5 x0,42 x3600 ~ 2,27×103 J.
B.2.2 Vérifier que la valeur de l’énergie massique (50 Wh kg-1) est cohérente avec la valeur de l’énergie disponible trouvée précédemment.
Masse de la pile m = 13 g.
1,5 x0,42 /0,013 ~48 Wh kg-1.
B.2.3 Réaliser la même vérification pour l’énergie volumique.(0,18 Wh cm-3).
On donne : volume du cylindre V = p.R2.h avec R le rayon du cylindre et h sa hauteur.
R = 5 mm ; h = 45 mm ; V = 3,14 x 5,02 x45 =3,5 103 mm3 =3,5 cm3.
1,5 x 0,42 / 3,5 ~0,18 Wh cm-3.
B.3 Détermination de la durée de vie de la pile.
L’intensité du courant nécessaire pour le fonctionnement d’une calculatrice est I = 1,5 mA.
La capacité disponible que la pile fournit est le produit de l’intensité du courant délivré I par la durée de fonctionnement t.
L’autonomie
des piles sera-t-elle suffisante pour la durée de votre scolarité au
lycée si vous utilisez votre calculatrice en moyenne 1 heure par
semaine ? Justifier votre raisonnement à l’aide de calculs.
Q = 0,42 Ah ; I = 1,5 10-3 A ; t = 40 x 3 = 120 h.
1,5 10-3 x 120 ~0,18 Ah. L'autonomie est suffisante.
B.4 Valorisation des piles usagées
B.4.1 La deuxième étape du procédé de valorisation des piles usagées est un tri magnétique. Comment peut-on mettre en oeuvre ce
tri ?
Les métaux ferreux sont attirés par un aimant et ainsi séparés des matériaux non ferreux, oxydes, amalgames et électrolytes.
B.4.2 Quelle est l’unité dans le système international du champ magnétique ?
Tesla ( T).
B.4.3 Rappeler l’ordre de grandeur du champ magnétique terrestre.
10-5 T.
B.4.4 L’étape de neutralisation a pour but de rendre les résidus obtenus à un pH neutre.
Quelle est la valeur du pH pour une solution neutre ?
A 25°C, un milieu neutre a un pH égal à 7.
B.4.5 Comment peut-on qualifier le pH indiqué dans le document B5 ( pH = 7,3) ?
Calculer la concentration en ions oxonium H3O+ d’une solution présentant le même pH.
Dans cette solution, la concentration en ions hydroxydes OH– est-elle plus grande ou plus petite que celle en ions oxonium H3O+ ? Justifier.
Le milieu est légèrement basique.
[H3O+] = 10-7,3 ~5,0 10-8 mol/ L.
[HO- ] = 10-14 / 10-7,3 =10-6,7 ~2,0 10-7 mol/ L.
[HO- ] > [H3O+].
|
....
|
Partie C: Traitement des déchets radioactifs produits par les hôpitaux (5,5 points)
Les hôpitaux français font partie, par l’intermédiaire de leurs
services de médecine nucléaire et des laboratoires de radioanalyse, des
producteurs de déchets radioactifs.
Il y a donc obligation pour ces hôpitaux de suivre une démarche de traitement de ces déchets.
Vous allez dans cette partie suivre l’évolution des déchets radioactifs obtenus après un test de Schilling.
C.1. Détermination de l’élément radioactif
C.1.1 En utilisant les documents, déterminer l’élément radioactif intervenant dans le test de Schilling.
Cobalt 57.
C.1.2 En justifiant la réponse, parmi les éléments suivants, donner le (ou les) isotope(s) du cobalt 57 : 26
5726Fe ; 6027Co ; 5728Ni ;
Deux isotopes ne diffèrent que par leur nombre de neutrons. Ils ont le même numéro atomique. 6027Co et 5727Co.
C.2. L’élément Cobalt 57
C.2.1 Donner la composition du noyau de cobalt 57 : 5727Co.
27 protons et 57-27 = 30 neutrons.
C.2.2 Le cobalt 57 est radioactif ß+. Donner le nom et la notation symbolique de la particule ß+.
Positon ; 01e.
C.2.3 Ecrire l’équation de désintégration du cobalt 57, en justifiant avec les lois de conservation.
5727Co ---> 5726Fe + 01e.
Conservation de la charge : 27 = 26 +1 ; conservation du nombre de nucléons : 27 = 27 +0.
C.3. Évolution de l’activité du cobalt 57 au cours du temps
C.3.1 Donner la définition d’une période radioactive (ou temps de demi-vie radioactive).
La période radioactive est la durée au bout de laquelle l'activité initiale est divisée par 2.
C.3.2 Vérifier que la période radioactive est cohérente avec celle donnée dans la notice du cyanocobalamine ( T ~271 jours ).
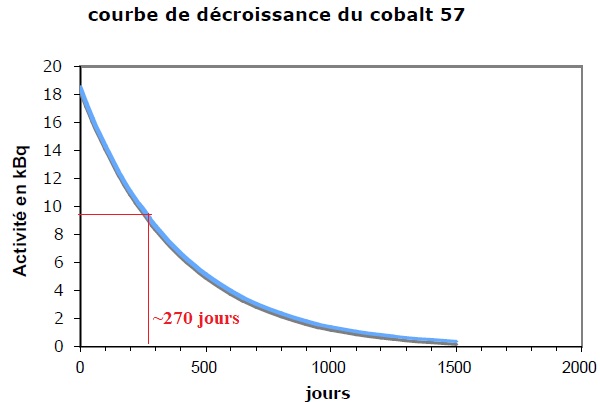
C.3.3 Pourquoi est-il précisé « à la date de calibration » sur la notice du médicament ?
L'activité du cobalt 57 diminue au cours du temps. L'activité est divisée par 2 au bout de 271 jours.
C.4. Traitement des déchets
En vous aidant des documents, comment faut-il traiter les déchets des gélules de cyanocobalamine ?
On donne 1 µg = 1×10–6 g.
Il s'agit de déchets à vie courte ( t½ < 31 ans ).
Activité maximale (Bq) / masse ( g) : 18,5 103 / 10-6 ~1,8 109 Bq / g = 1 GBq / g.
Moyenne activité : stockage en surface.
|
|

