Biocarburants
à base d'éthanol.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
1.
Filière de production du bioéthanol.
Q1. Elaborer un
corrigé et un barème sur 6 points pour l'exercice suivant.
On distille une solution constituée uniquement d'eau et d'éthanol. A
l'entrée de la colonne de distillation, la solution a une fraction
molaire en éthanol x = 0,03. On obtient en sortie de tête de colonne
une solution aqueuse de fraction molaire en éthanol x = 0,88.
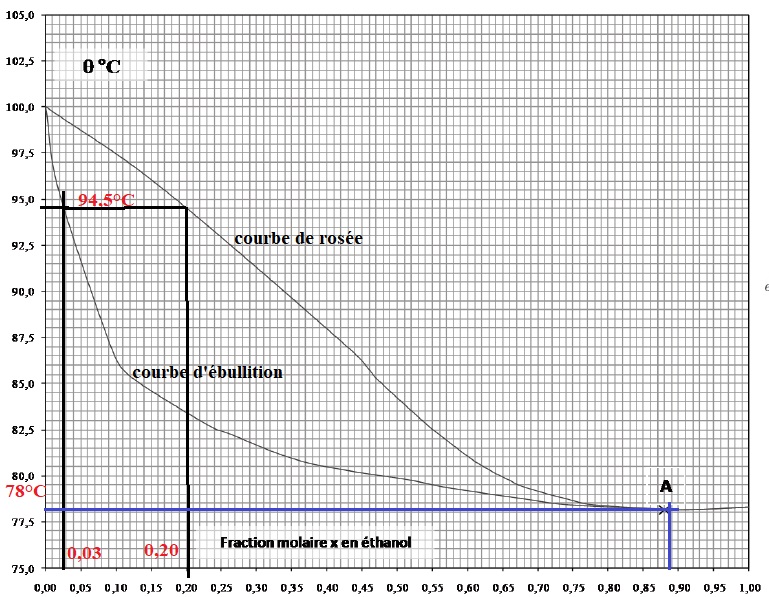
1.1. Préciser sur le diagramme isobare d'équilibre liquide-vapeur, où
se situent la courbe de rosée et la courbe d'ébullition.
1.2 Déterminer la température d'ébullition et la composition des
vapeurs formées par le mélange à l'entrée de la colonne. Justifier
graphiquement.
1.3 Quel est le nom donné au mélange correspondant au point A ?
1.4 Déterminer la température des vapeurs en tête de colonne.
Q1 : noms des courbes : ½ point +½ point.
Q2. Pour x = 0,03 ( données du texte) 0,5 point ; on lit
graphiquement Te = 94,5 °C ( 1 point ).
La composition des vapeurs est lue sur la courbe de rosée 0,20 ( 20 %)
en éthanol. ( 1 point).
Q3. Le mélange au point A est un azéotrope ( 1 point).
Q4. En tête de colonne la température des vapeurs est 78°C ( 1,5 point).
Q.2.. Un élève n'a pas compris
pourquoi le distillat ne contenait pas d'éthanol pur.
Proposer une explication. Indiquer une autre difficulté qu'un élève
aurait pu rencontrer lors de la résolution de cet exercice..
L'azéotrope en sortie de colonne est un mélange qui se comporte comme
un corps pur. Sa température d'ébullition reste égale à 78 °C. La
composition des vapeurs est identique à celle du liquide. On ne peut
pas distiller un azéotrope.
Un élève peut rencontrer des difficultés à utiliser correctement
le graphique.
2. Avantages
et inconvénients de l'éthanol.
Avantages :
biosourcé, faible vapeur saturante, indice d'octane élevé, densité
proche de celle des essences.
Inconvénients : contenu énergétique plus faible à cause de la présence
d'oxygène, miscibilité avec l'eau, oxydation possible en acide
acétique, corrosion accrue des matériaux.
Pour l'équilibre liquide - vapeur d'un corps pur, la relation de
Clapeyron permet d'évaluer la pente de la courbe de vaporisation en un
point de coordonnées ( T, P) donné :
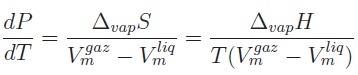
Vm désigne le volume molaire du corps pur, DvapS son
entropie molaire de vaporisation et DvapH
son enthalpie molaire de vaporisation.
Q3.
En supposant que le gaz soit parfait, et à partir d'autres hypothèses
que l'on précisera, montrer que l'on peut aboutir à la loi de Rankine,
en précisant l'expression du paramètre B :
ln(P) = A - B / T.
Hypothèse n° 1
: le volume molaire d'un liquide est très inférieur au volume molaire
d'un gaz : Vmgaz >> Vm liq.
Hypothèse n°2
: le gaz est supposé parfait . La loi des gaz parfaits conduit à :: P Vmgaz
= RT.
Par suite : dP / dT = Dvap H / (T Vmgaz)
= Dvap
H P / ( RT2).
dP / P = Dvap H dT /
( RT2).
Enfin par intégration : ln(P) = - Dvap H T /
( RT) + constante.
On identifie B à Dvap H / R.
Les paramètres A et B sont ajustables. On utilise des formes
fonctionnelles empiriques ayant plus de paramètres, par exemple
l'équation d'Antoine : log ( P / P°) = A -B / (T + C) où P° = 1 bar.
On donne les paramètres de cette équation pour l'éthanol, l'hexane et
l'octane.
|
A
|
B(K)
|
C(K)
|
Gamme
de température (K)
|
éthanol
|
5,372
29
|
1670,409
|
-40,191
|
273
- 351
|
hexane
|
4,002
66
|
1171,53
|
-48,784
|
286
- 342
|
octane
|
5,2012
|
1936,281
|
-20,143
|
217
- 297
|
Q4.
Classer ces trois espèces par ordre de volatilité croissante pour des
températures voisines de 20°C et conclure quant à l'utilisation de
l'éthanol comme carburant.
Ethanol : log (P / P°) = 5,372 29-1670,409 /(293-40,191) = -1,235 ; P =
5,8 10-2 bar.
Hexane : log (P / P°) = 4,002 66-1171,53 /(293-48,784) =
-0,795 ; P = 0,16 bar.
Octane : log (P / P°) = 5,2012-1936,281 /(293-20,143) =
-1,895 ; P = 1,27 10-2 bar.
Le liquide est d'autant plus volatil que sa pression de vapeur
saturante est élevée : hexane > éthanol > octane.
L'éthanol et les hydrocarbures de l'essence ( constituée
essentiellement d'octane) ont une volatilité comparables. En
conséquence, l'éthanol peut être utilisé comme carburant.
Q5. Interpréter
les différences de température de changement d'état entre l'octane et
l'hexane.
Téb ( octane) = 126 °C ; Téb ( hexane) = 69 °C.
La température d'ébullition des alcanes est d'autant plus élevée que :
- le nombre d'atome de carbone de la chaîne principale croît. Les
liaisons faibles de type Van Der Waals sont plus
nombreuses dans l'octane que dans l'hexane.
-à nombre d'atomes de carbone identique, le nombre de ramifications sur
la chaîne principale est plus faible.
Q6. Pourquoi l'éthanol est-il
miscible avec l'eau ?
L'eau
et l'éthanol sont des molécules polaires ( présence d'un atome
d'oxygène très électronégatif possédant de plus deux doublets non
liants Ces molécules peuvent
établir des liaisons hydrogène intermoléculaires.
Ajoutons que la chaîne carbonée de l'éthanol est courte ( 2 atomes de
carbone ).
En conséquence l'eau et l'éthanol sont miscibles en toutes proportions.
Q7.
L'utilisation du butan-1-ol à la place de l'éthanol pourrait-elle être,
de ce point de vue, un avantage ou un inconvénient ? Justifier.
Le butan-1-ol, comme tous les alcools, peut également former des
liaisons hydrogène avec l'eau.
Mais la chaîne carbonée du butan-1-ol est plus grande ( 4 atomes
de carbone au lieu de 2) que celle de
l'éthanol. Le butan-1-ol et l'eau ne seront pas miscible s en toute
proportion. C'est donc un avantage pour un carburant.
|
...
|
|
3. Contenu énergétique.
Q8.
Proposer une expérience mettant en jeu l'énergie chimique et illustrant
la notion de conversion d'énergie dans le programme du cycle 4.
Préciser les apprentissages que cette expérience permettrait de
construire.
Utiliser une lampe à mèche contenant 10 mL d'éthanol
pour réchauffer 100 mL d'eau contenu dans un becher. Faire peser la
lampe à éthanol et mesurer la température de l'eau avant et après
combustion.
On constate que la masse d'éthanol diminue et que la température
de l'eau augmente. De l'énergie chimique est convertie en énergie
thermique.
Q9. Ecrire
l'équation de combustion complète de l'éthanol liquide en considérant
que les produits sont en phase vapeur.
C2H6O(l) + 3O2(g) ---> 2 CO2(g)
+ 3H2O(g).
Q10.
Calculer le pouvoir énergétique (PE) de l'éthanol, c'est à dire
l'énergie libérée par la combustion complète d'un kilogramme d'éthanol.
Etape 1 :
enthalpie molaire de combustion de l'éthanol :
DrH°
= 2 DfH°(CO2)
+ 3 DfH°(H2O)
- 3 DfH°(O2)
- DfH°(éthanol)
=2 (-393,51) + 3(-241,83) -(-277,69) -3 x0 = -1234,82 kJ / mol.
Etape 2 :
quantité de matière d'éthanol dans 1 kg : n = 1000 / 46 = 21,7
mol.
Etape 3
:PE ( éthanol) = 21,7 x(-1234,82) ~ -2,68 104 kJ = -26,8 MJ.
Q11.
L'utilisation du carburant E85 entraîne une surconsommation de
carburant. Calculer cette surconsommation ( exprimée en %) par rapport
à un carburant traditionnel.
Etape 1 :
Energie libérée par la combustion d'un litre de carburant de masse
molaire M et de masse volumique r
( g ) L)
E = n | DrH°
| = m / M | DrH°
| = r | DrH° | / M avec r en g / L.
Etape 2 :
enthalpie formation standart de l'octane :
réaliser
un cycle thermochimique :
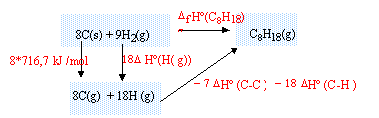
DfH° (C8H18)
= 8*716,7+18DfH° (H(g))- 7 DfH° (C-C)-18DfH°
(C-H)
DfH° (C8H18)
= 5733,6 +18*218 -7 *345 -18*415 = -227,4
kJ/mol.
Etape
3 : combustion de l'octane :
C8H18
(g) + 12,5 O2 (g)-->8 CO2 (g) + 9 H2O
(g)
DrH° comb = 9DfH° (H2O(g))+8 DfH° CO2 (g) - DfH°
C8H18(g)
DfH° (O2(g))
= 0 corps pur simple dans son état de référence
DrH° comb = 9 *
(-241,83)+ 8*(-393,5) +227,4 = -5097 kJ/mol.
Etape 4 :
pour l'essence ( constituée principalement d'octane), l'énergie
volumique vaut : 0,70 x 5097 / 114 = 31 kJ / L.
Pour le carburant E 85 ( 15 % octane + 85 % éthanol) :
0,15 x0,70 x5097 /114 + 0,85 x0,79 x1235 / 46 ~23 kJ / L..
Surconsommation : (31-23) / 31 ~0,26 ( 26 %).
|
....
|
4. Problème de corrosion.
Du fait de sa légéreté et de sa résistance à la corrosion, l'aluminium
( et ses alliages) est de plus en plus utilisé dans la construction
automobile. L'éthanol pose des problèmes de corrosion à cause de sa
conductivité élevée à température ambiante : 1,5 10-3 µS cm-1
contre 10-7 pour l'essence.
On donne le diagramme potentiel-pH de l'aluminium. L'activité des
espèces dissoutes est égale à 10-6. Les droites en
pointillés ( a et b) délimitent le domaine de stabilité de l'eau.
Q12. Attribuer en
le justifiant les domaines A, B, C et D à chacune des espèces Al(s), Al3+aq,
Al2O3(s) et AlO2-(aq)..
Préciser les zones d'immunité, de corrosion et de passivation de
l'aluminium.
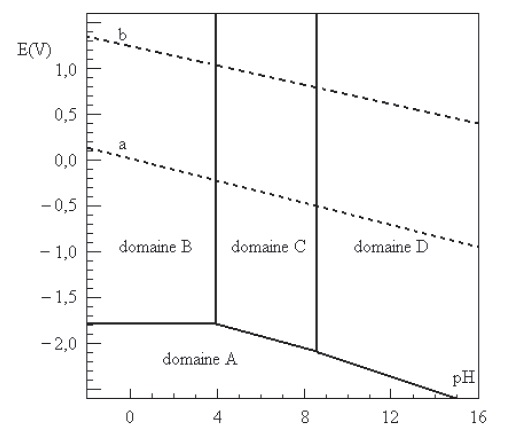
Domaine A : Al(s), degré d'oxydation 0. Immunité.
Al3+aq,
Al2O3(s) et AlO2-(aq). Le
degré d'oxydation de l'aluminium est égal à + III, donc partie
supérieure.
Domaine B : en milieu a pH faible Al3+ aq. Corrosion.
Domaine D : en milieu basique, pH élevé, AlO2-(aq).prédomine.
Corrosion.
Domaine C : Al2O3(s).
Passivation.
Q13.
Déterminer l'équation de la frontière entre les domaines A et C et
écrire l'équation de passivation de l'aluminium en milieu aqueux.
Etape 1
: Equation de la réaction de l'équilibre C - A :
(4) 0,5Al2O3(s)
+ 3H+aq + 3 e-=
Al (s) + 1,5H2O(l).
Equation de Nernst : E = E°(Al2O3(s)
/Al(s) ) +0,06 log( [H+]).
E = E°(Al2O3(s)
/Al(s) ) -0,06 pH.
Etape 2 : Calcul de
E°(Al2O3(s)
/Al(s) ) :
(1) : 0,5Al2O3(s)
+1,5H2O = Al3+
aq + 3 HO-aq ;
K = 10-36,3. DG°1
= -R T ln K
(2) : Al3+aq + 3e-
= 3Al(s). E°2(Al3+
aq / Al(s) = -1,67 V.
DG°2
= --nFE°2.
(3) : 3 H+aq + 3HO-
aq = 3H2O. DG°3 = -3R T ln
(1/Ke).
(1) +(2) +(3) donne (4) : DG°4 = -n
F E°(Al2O3(s)
/Al(s) ) =
-R T ln K
-nFE°2 -3R
T ln Ke.
E°(Al2O3(s)
/Al(s) ) = 0,02 log K + E°2
+
0,06 log(1 /Ke) ]= -0,716 -1,67 +0,84 ~ -1,55 V.
E = -1,55 -0,06 pH.
Le domaine A et le domaine de stabilité de l'eau sont disjoints. L'eau
réagit avec l'aluminium selon :
Oxydation : 2Al(s) + 6HO-aq = Al2O3(s)
+ 3H2O + 6e-.
Réduction : 6H2O +6e- = 3H2(g) + 6HO-aq.
Equation de passivation de l'aluminium : 2Al(s)
+3H2O
= Al2O3(s) + 3H2(g).
|
Le processus de corrosion alcoolique est
modélisée par :
3 EtOH( l) + Al(s) = Al(OEt)3(s) +1,5 H2(g).
Q14. Ecrire les
demi-équations modélisant les réactions ayant lieu à l'anode et à la
cathode de la pile de corrosion.
Oxydation de Al à l'anode : Al(s) = Al3+aq + 3e-.
Réduction de l'alcool à la cathode : EtOH + e- = EtO-
+ 0,5 H2(g).
Q15. Schématiser la
pile de corrosion. Préciser les différents porteurs de charges ainsi
que leur sens de déplacement dans la pile.
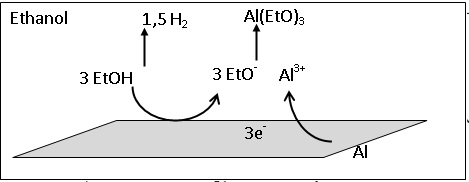
Les électrons se déplacent dans le métal; les ions et le dihydrogène
passent en solution.
Q16. Schématiser le
montage électrique qui a servi à réaliser les courbes de polarisation
suivantes. Quelle est le rôle de l'électrode de platine ?
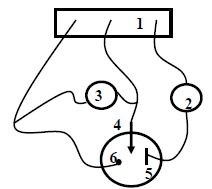
(1)
: potentiostat ; (2) milliampèremètre en série ; (3) voltmètre en
parallèle ; (4) électrode de travail ; (5) électrode auxiliaire en
platine ; (6) électrode de référence.
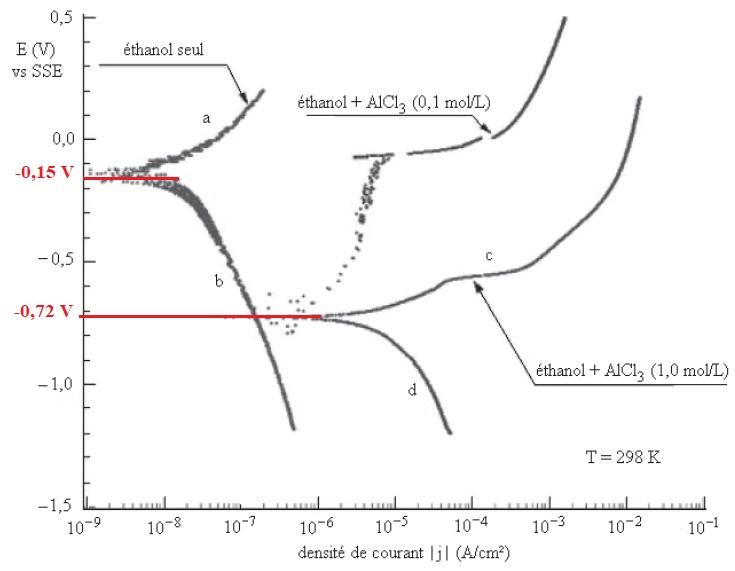
Q17. Pour les
courbes repérées par les lettres a, b, c et d, indiquer s'il s'agit
d'une partie anoqique ou cathodique et préciser les couples mis en jeu.
Courbes a et c : courant anodique, oxydation de l'aluminium ( couple Al3+
/ Al ).,
Courbes b et d, courant cathodique, réduction de l'éthanol ( couple (
EtOH / EtO-).
Q18. Déterminer
graphiquement le potentiel de corrosion pour les deux expériences "
éthanol seul" et " éthanol + AlCl3 à 1,0 mol / L". Les
valeurs obtenues sont-elles cohérentes ? Justifier.
Au potentiel de corrosion la réaction
anodique a lieu à la même vitesse que la réaction cathodique.
Ethanol seul : -0,15 V ; éthanol en présence AlCl3 : -0,72 V.
|
|
|