L'homme
pour défendre la nature, Capes physique chimie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
A.
Des ions sulfate sont rejetés dans l'environnement aquatique. A partir
du seuil de 500 mg d'ion sulfate par litre, l'eau nécessite un
traitement.
Titrage conductimétrique des ions sulfates dans un effluent de tannerie.
Prélever à l'aide d'une pipette jugée V0 = 20,0 mL d'effluent et placer dans un becher.
Ajouter 100 mL d'eau distillée.
Introduire la sonde condictimétrique.
Sous agitation, doser par une solution aqueuse de chlorure de baryum à C = (1,00 ±0,02) 10-2 mol /L.( incertitude élargie à 68 %).
Mesurer l'évolution de la conductivité.

Q17. Apporter un regard critique au document suivant.
Pipettes jaugées
|
Fioles jaugées
|
Butette graduée
|
10 ±0,02 mL
|
20 ±0,03 mL
|
25 ±0,05 mL
|
100 ± 0,1 mL
|
200 ± 0,2 mL
|
25 ± 0,05 mL
|
Désacord entre les chiffres significatifs ; il faudrait écrire par exemple :10,00 ±0,02 mL ; 100,0 ±0,1 mL.
Q18. L'eau de la tannerie nécessite-t-elle un traitement ?
SO42- aq +Ba2+aq ---> BaSO4 (s).
A l'équivalence : C VE = C V0 ; C = 1,0 10-2 x12 / 20 =6,0 10-3 mol /L d'ion sulfate.
M(sulfate) = 32 +4 x16=96 g/mol.
tsulfate =96 x6,0 10-3 =0,576 g /L ou 576 mg / L d'ion sulfate.
Incertitude :U(tsulfate) / tsulfate=[(U(VE) / VE)2 +(U(V0) / V0)2 +(U(C) / C)2 ]½ =[(0,5/12)2 +(0,03/20)2 +(0,02/1,00)2 ]½=4,6 10-2.
U(tsulfate) =576 x4,6 10-2 ~ 27 mg.
tsulfate= 576 ±27 mg / L, valeur supérieure à 500 mg / L.
L'eau nécessite un traitement.
Q19. Proposer une structure de Lewis probable pour l'ion sulfate.
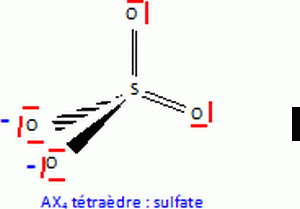 Q20.
Un professeur en classe STL- SPCLpropose une activité sur le dosage des
ions sulfate dans l'eau. Trois compétence seront évaluées. Donner les
éléments constituant l'activité expérimentale.
Q20.
Un professeur en classe STL- SPCLpropose une activité sur le dosage des
ions sulfate dans l'eau. Trois compétence seront évaluées. Donner les
éléments constituant l'activité expérimentale.
Problématique :
Une nouvelle chaîne de production rejette des effluents contenant des ions sulfate.
Compétences évaluées :
Réaliser un dosage conductimétrique ; analyser la courbe obtenue.Communiquer sous forme d'un compte rendu écrit.
Documents disponibles :
réglementation concernant les effluents contenant des ions sulfate ;
schéma et principe du titrage de ces ions ; matériel et solutions
disponibles.
|
...
|
|
|
....
|
B. La chlorose ferrique est une maladie des plantes ( jaunissement des feuilles) due à une carence en fer.
Q21.
Ecrire la structure électronique fondamentale de l'ion fer (III). Fe ( Z = 26).
L'ion fer (III) possède 26-3 = 23 électrons.
1s2 2s2 2p6 3s2 3p6 4s0 3d5.
Q22. Un protocole expérimental de dosage des ions Fe3+
présents dans le sol par spectrophotométrie UV visible a été proposé à
des élèves de première STL SPCL. Corriger le compte rendu de l'élève en
repérant les erreurs en annotant la copie et en formulant des conseils
appropriés.


Q23. En utilisant
un diagramme de prédominance gradué en pSCN, montrer que les conditions
expérimentales permettent d'affirmer que le complexe
[Fe(SCN)]2+ est majoritaire.
L'acide chlorhydrique maintient un pH suffisamment faible pour empécher Fe(OH)3 de précipiter.
Formation de ce complexe : Fe3+aq +SCN-aq ---> [Fe(SCN)]2+ aq.
Constante d'équilibre K = [ [Fe(SCN)]2+ aq] / ([ Fe3+aq] [ SCN-aq ]) = 103,1.
log( [Fe(SCN)]2+ aq] / ([ Fe3+aq]) - log([ SCN-aq ]) =3,1.
log( [Fe(SCN)]2+ aq] / ([ Fe3+aq]) +pSCN = 3,1.
Si pSCN > 3,1 ; log( [Fe(SCN)]2+ aq] / ([ Fe3+aq]) est négatif : [ Fe3+aq] prédomine.
Si pSCN < 3,1 ; log( [Fe(SCN)]2+ aq] / ([ Fe3+aq]) est positif : [Fe(SCN)]2+ aq] prédomine.
Concentration en ion SCN- : 2 mol / L.
1 mL de solution de thioscyanate de potassium des 50,0 mL soit 2 / 50 = 0,04 mol/L en ion thioscyanate.
pSCN = -log (0,04) =1,4.
Cette vbaleur étant inférieure à 3,1, [Fe(SCN)]2+ aq] prédomine.

|
C. Le projet Biorock vise à protéger et restaurer les récifs coralliens.
Dans
cet exercice, on se propose d’étudier la reconstitution des récifs
coralliens dans l’île de Bali, grâce à la technique de l’électrolyse. À
Bali, la croissance moyenne du squelette des coraux naturels est de
l’ordre de 2 mm par an. Une équipe de chercheurs souhaite fabriquer un
récif corallien artificiel à Permutaran grâce à la technique « Biorock
».
Ils ont besoin pour cela de déposer du carbonate de calcium sur des structures métalliques..
Le dispositif installé au nord de Bali est réalisé avec des moyens très simples :
- le fer acheté sur les marchés locaux est soudé sur place ;
- des plongeurs attachent des coraux à cette grille avec du fil de fer fin ;
- l’installation est électrifiée sous une tension de 3,0 V et un courant de 10 A.
La cathode est le siège d’une réduction modélisée par la demi-équation suivante :
2 H2O(ℓ) + 2e – = H2(g) + 2 HO –(aq) (1)
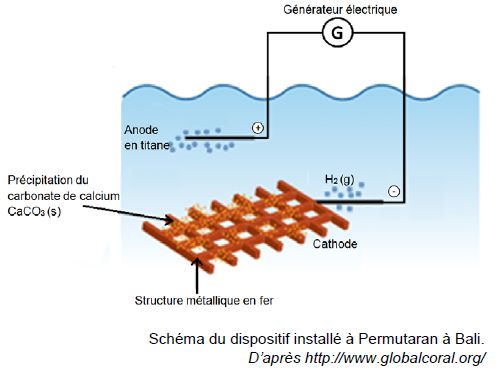
Le dioxyde de carbone CO2 présent dans l’atmosphère et dissous dans l’eau ainsi que les ions Ca2+ présents naturellement dans l’eau de mer réagissent avec les ions HO- produits à la cathode pour former le carbonate de calcium selon la réaction suivante :
Ca2+(aq) + CO2(g) + 2 HO- (aq) --> CaCO3(s) + H2O(ℓ) (2)
On ne tiendra pas compte des réactions de précipitation des autres ions présents dans l’eau de mer.
Q25.
Estimer le temps nécessaire à partir duquel la précipitation du
carbonate de calcium s'amorce au voisinage d'une portion de cathode
immergée ( tige de longueur L = 1,0 m et de diamètre d = 5,0 cm).
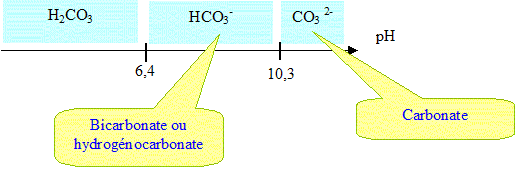
L'espèce HCO3- prédomine dans l'eau de cette mer ( pH = 7,6).
Concentration de HCO3- dans cette mer : 2,2 10-3 mol/L.
Concentration des ion H3O+ : 10-7,6 =2,5 10-8 mol/ L <<2,2 10-3 mol/L.
Les ions hydroxyde produits au voisinage de la cathode réagissent essentiellement avec les ions HCO3- selon :
HCO3- aq +HO-aq ---> CO32-aq +H2O(l).
La précipitation du squelette calcaire s'amorce dès que le pourcentage
d'ion carbonate au voisinage de la cathode a dépassé les 5 % de la
quantité totales en solutés carbonatés.
[CO32-aq]fin = 0,05 [HCO3- aq]initial =0,05 x 2,2 10-3 =1,1 10-4 mol / L.
La concentration en ion hydroxyde doit donc atteindre 1,1 10-4 mol / L.
On observe une augmentation du pH au voisinage de la cathode sur une épaisseur voisine de r= 1,0 mm.
Volume d'eau influencé par la croissance du pH :
V = L p [(R+r)2-R2] ~2L p r R =L p r d= 1,0 x3,14 x0,05 x 10-3 ~1,57 10-4 m3 ou 0,157 L.
Il faut produire : 0,157 x1,1 10-4 =1,73 10-5 mol d'ion hydroxyde.
Quantité de matière d'électrons : 1,73 10-5 mol.
Quantité d'électricité correspondante : Q = 1,73 10-5 x96500 =1,67 C.
Durée nécessaire : Q / I = 1,67 / 10 ~0,17 s.
|
|
|






