Chimie
en milieu interstéllaire,
Concours général physique 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
|
35.
36. En
spectrométrie de masse, le rapport m /z est égal à la masse exprimée en
unité de masse atomique divisée par le nombre de charge de l'ion.
Pour H3+ : m / z = 3 /1 = 3.
Pour C4+ : m / z = 12 /4 = 3.
Un pic à m /z = 3 peut correspondre à plusieurs ions.
37. L'existence de C4+ implique l'existence de C3+ pour lequel m /z =12 /3 = 4.
Or il n'y a pas de pic à m /z = 4. C3+ n'est pas présent et en conséquence C4+ ne l'est pas non plus.
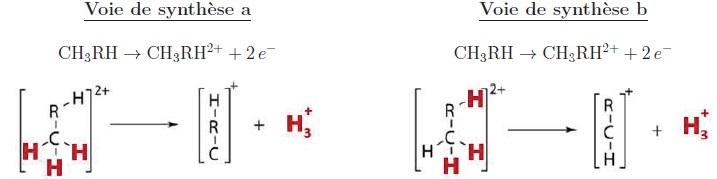
38. Le carbone central de la molécule d'acétone ne porte pas d'atome d'hydrogène. La synthèse notée b n'est pas réalisable.
Les atomes de carbone 1 et 3 portent chacun 3 atomes d'hydrogène. La synthèse notée a est réalisable.
Dans la molécule d'éthylène glycol HO--CH2--CH2--OH :
- les atomes de carbone ne portent pas trois atomes d'hydrogène : la synthèse notée a n'est pas réalisable.
Les atomes de carbone centraux portent deux atomes d'hydrogène et les
atomes d'oxygène voisins portent un atome d'hydrogène : la synthèse
notée b est réalisable.
39. Acétone : seule la synthèse notée a est réalisable ; la présence de H3+ le confirme.
Ethylène glycol : seule la synthèse notée b est réalisable ; la présence de H3+ le confirme.
40. Écrire les deux voies possibles de formation de l’ion H3+ en partant du méthanol doublement ionisé. On identifiera spécifiquement les atomes participant à la formation de H3+
.Au départ du méthanol ionisé [CH3--OH]2+ :
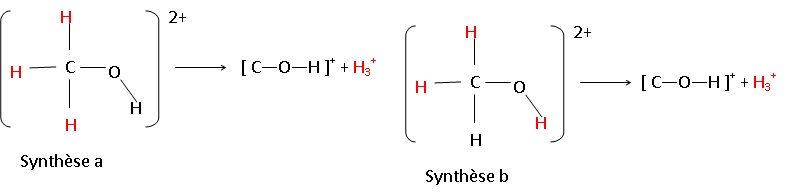
41. Etude des pics correspondants :
C-O-H : m =29 ; z = 1 ; m / z =29 .
H3+ = m = 3 ; z = 1 ; m / z = 3.
Pour les deux synthèses on doit observer ces deux pics.
L’expérience est renouvelée avec la molécule de méthanol deutéré CH3OD qui est une molécule de méthanol dans laquelle l’hydrogène 11H lié à l’oxygène a été remplacé par un atome de deutérium 21H noté D.
42. Comment
appelle-t-on la relation qui existe entre l’hydrogène et le deutérium ?
Pourquoi peut-on estimer la masse d’un atome de deutérium à environ
égale à deux fois celle d’un atome d’hydrogène ?
L'atome d'hydrogène et l'atome de deutérium ne diffèrent que par leur nombre de neutrons : ils sont isotopes.
La masse de l'électron est négligeable devant la masse d'un nucléon, proton ou neutron.
Masse de l'atome d'hydrogène mH = m proton ;
masse de l'atome de deutérieum : mD = m proton + mneutron ~2 mproton.
Donc mD = 2 mH.
|
|
|
43. Au départ du méthanol deutéré doublement ionisé :
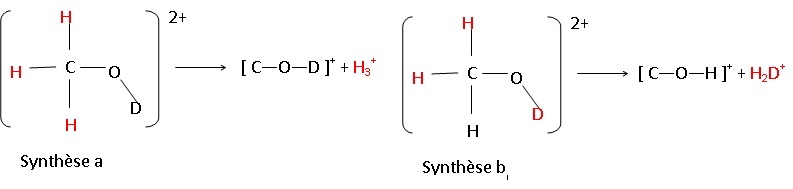
Pour l'ion H2D+ : m = 2+2 = 4 ; z = 1 ; m /z =4.
Pour l'ion [C-O-D]+ : m =12+16+2 = 30 ; z = 1 ; m / z = 30.
La présence des pics à m/z = 30 et m /z = 4 prouve l'existence des deux voies de synthèse dans le cas du méthanol.
44. Une espèce susceptible de céder un proton est un acide.
Lors de la première étape de la synthèse de l'eau, l'oxygène gagne un proton ; il se comporte comme une base.
45.
La poussière permet donc de rapprocher les atomes les uns des autres
pour favoriser leur réaction, accélérant ainsi la formation de
molécules d’eau. Comment appelle-t-on ce type d’acteurs dans une
réaction chimique ?
Un catalyseur favorise une réaction chimique. Il n'est pas consommer lors de la réaction.
il intervient lors de la première étape et se trouve régénérer lors de la dernière étape.
Lorsque les réactifs sont gazeux et le catalyseur solide, la catalyse est hétérogène.
46.
Lors du processus de physisorption, les atomes vont se fixer à la
surface de la poussière en établissant des interactions faibles avec
celle-ci. De quel type d’interactions peut-il s’agir ?
Les interactions faibles de Van der Waals fixent les atomes à la surface de la poussière.
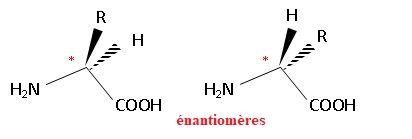
47. Les molécules possèdent un atome de carbone asymétrique : elles sont chirales.
48. 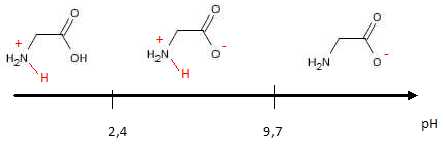 . .
La forme zwitterionique prédomine en milieu aqueux si le pH est compris entre 2,4 et 9,7.
A pH inférieur à 2,4, H3N+-CH2-COOH prédomine.
A pH supérieur à 9,7, H2N-CH2-COO- prédomine.
|
...
|
|
.
|
....
|
49. Un mélange est qualifié de racémique lorsqu'il contient les deux énantiomères en quantité égale.
50. Dans les météorites, la synthèse des acides aminés conduit au mélange racémique.
Sur terre, la majorité des acides aminés se présentent sous la forme L.
Lors d'une contamination, la proportion de la forme L croît par rapport au récémique.
Cette méthode ne fonctionne que pour les acides aminés chiraux et pas pour ceux qui ne le sont pas, comme la glycine.
51. Préparation d'une solution de soude à 0,20 mol /L.
Masse molaire de la soude NaOH : M = 23 +16 +1 = 40 g/mol.
Masse de soude dans 1 L : 40 x0,2 = 8,0 g.
Protocole pour préparer 0,25 L de soude à 0,20 mol/L :
peser 2,0 g de soude
placer ce solide dans une fiole jaugéede 250 mL contenant 2 / 3 d'eau distillée.
agiter pour dissoudre le solide.
Compléter jusqu'au trait de jauge avec de l'eau distillée.
Agiter pour rendre homogène.
52. La méthode précédente ne permet pas de fabriquer une solution de soude de concentration précise.
Le solide NaOH absorbe de l'eau et ce solide peut contenir des impuretés.
Il faut donc réaliser un titrage pour connaître sa concentration exacte.
53. Le pH initial de la solution titrée est voisin de 6. La glycine est sous la forme H3N+-CH2-COO-.
54. Réaction support du titrage :
H3N+-CH2-COO- aq + HO-aq ---> H2N-CH2-COO- aq + H2O.
54. VE =7,5 mL.
A l'équivalence Cglycine Vglycine = Csoude VE.
Cglycine =0,20 x7,5 / 10,0 = 0,15 mol/L.
|
|





