Physique
chimie, cannabis, alcool et sécurité routière, bac St2S 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
Cannabis et airbag. ( 12 points).
Un
conducteur accidenté avait consommé du cannabis peu de temps avant de
prendre le volant. La substance active de cette drogue est le THC de
formule suivante.
Partie 1.
1. Entourer les groupes fonctionnels présents et les nommer.
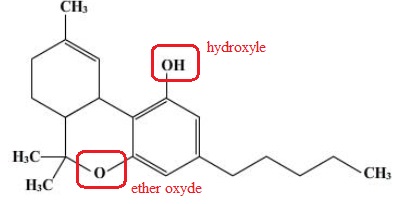
2. Justifier la solubilité du cannabis dans les graisses.
La molécule possède une longue chaine carbonée ( à 5 atomes de carbone) ainsi que deux cycles à 6 atomes de carbone.
Les acides gras naturels possèdent également de longues chaines carbonées.
Le cannabis est donc soluble dans les graisses.
Partie 2. La chimie de l'airbag.
Lors d'un choc violent, une étincelle déclenche la décomposition de l'azoture de sodium NaN3(s) présent dans l'airbag en sodium Na(s) et en diazote N2(g).
2 NaN3(s) ---> 2 Na(s) +3 N2(g). (1).
Le sodium produit réagit immédiatement avec du nitrate de potassium KNO3(s) présent dans l'airbag.
10 Na(s) + 2 KNO3(s) ---> N2(g) +5 Na2O(s) + K2O(s). (2).
Enfin : Na2O(s) + K2O(s) +SiO2(s) ---> K2Na2SiO4(s) (3).
3. Tous les
réactifs mis en jeu sont entièrement consommés. Identifier les deux
espèces chimiques restantes à l'issue des trois transformations et
indiquer celle qui provoque le gonflement de l'airbag.
K2Na2SiO4(s) et N2(g).
Le diazote gazeux provoque le gonflement de l'airbag.
4. Etablir la relation entre la quantité de matière de diazote forméé n1(N2) et la quantité de matière d'azoture de sodium nd(NaN3). Même question avec n1(Na) et nd(NaN3).
D'après l'équation (1) : n1(N2) = 1,5 nd(NaN3)
n1(Na) = nd(NaN3).
5. Etablir la relation entre la quantité de matière de diazote formé n2(N2) lors de la deuxième transformation et nd(NaN3).
n2(N2) = n1(Na) / 10 = 0,1 n1(Na) = 0,1 nd(NaN3).
6. En déduire que la quantité totale de diazote formée est nT(N2) = 1,6 nd(NaN3).
nT(N2) = n1(N2) + n2(N2) =1,5 nd(NaN3) + 0,1 nd(NaN3) =1,6 nd(NaN3).
7. La masse
d'azoture de sodium décomposé lors du déclenchement de l'airbag est
égale à 82,0 g. Calculer le volume de l'airbag gonflé.
M(NaN3) = 23,0 + 3 x14,0=65,0 g.
nd(NaN3) = 82,0 / 65,0 ~1,26 mol.
nT(N2) =1,6 * 1,26 ~2,02 mol.
Volume molaire des gaz : 24 L / mol.
Volume de l'airbag gonflé : 2,02 * 24 ~48,4 L.
|
|
|
Ethylotest chimique. ( 8 points).
Il est constitué d'un ballon de volume 1,0 L et d'un tube de verre rempli d'un gel contenant des ions dichromate Cr2O72- de couleur orange et de l'acide sulfurique.
Après avoir bu, une partie de l'alcool migre du sang vers l'air des
poumons. Cet éthanol passant dans le tube en verre de l'éthylotest
provoque la transformation chimique des ions dichromate en ion chrome
III, Cr3+ de couleur verte.
Couples oxydant / réducteur.
acide éthanoïque C2H4O2 / éthanol C2H6O : C2H4O2 + 4H+ + 4e- =C2H6O + H2O.
Cr2O72- / Cr3+ : Cr2O72-+ 14H+ + 6 e- = 2Cr3+ + 7H2O.
1. Nommer l'espèce chimique qui provoque la transformation chimique des ions dichromate en ion chrome (III).
L'éthanol, le réducteur le plus fort, s'oxyde en acide éthanoïque.
2. Présicer, en cas de test est positif, si les ions dichromate sont oxydés ou réduits.
Les ions dichromate gagnent des électrons. Cr2O72-est un oxydant qui se réduit.
3. Ecrire l'équation de la réaction d'oxydoréduction entre les ions dichromate et l'éthanol.
3 fois{C2H6O + H2O = C2H4O2 + 4H+ + 4e-}oxydation
2 fois{ Cr2O72-+ 14H+ + 6 e- = 2Cr3+ + 7H2O } réduction
Ajouter et simplifier : 2Cr2O72-+ 16H+ +3C2H6O --> 3C2H4O2 + 4Cr3+ + 11H2O.
4. Expliquer le rôle de l'acide sulfurique dans la transformation chimique.
Cet acide est l'un des réactifs ; Cr2O72-est un oxydant puissant en milieu acide, capable d'oxyder l'éthanol.
L'ion sulfate est spectateur.
5. Le mode d'emploi indique :
gonfler complètement le ballon ; presser le ballon pour le vider lentement et entièrement ; attendre 2 minutes pour le résultat.
Indiquer en quoi le respect de ces indications est indispensable pour que le résultat soit fiable.
Le ballon sous-gonflé conduit à une quantité d'alcool dans l'air expiré insuffisante.
Vider lentement et complètement le ballon gonflé afin que tout
l'éthanol contenu dans le ballon traverse le dichromate de potassium.
La réaction d'oxydoréduction est rapide mais pas instantanée, d'où les deux minutes d'attente.
|
|
