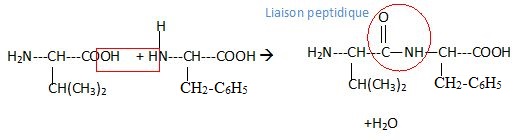Physique
chimie, l'eau potable, les savons, la spiruline,bac ST2S polynésie 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Distribution
d'eau potable. ( 8 points ).
Une pompe a été installée dans le puits d'un village pour alimenter un
réservoir d'eau muni d'un robinet.
1. Débit de la pompe.
Le débit constant est D = 0,45 L / s.
La pompe fonctionne au maximum 6 heures par jour.
1.1. Donner l'unité du débit dans le
système internationnal.
D s'exprime en m3 s-1.
1.2. Exprimer le
débit D en fonction du volume débite V et le temps d'écoulement Dt.
D = V / Dt.
1.3. Montrer que
les habitants peuvent récupérer un volume maximal d'eau potable V
= 9,7 m3 par jour.
V= 0,45 x 6 x3600 =9,7 103 L / jour = 9,7 m3 /
jour.
Le
village compte 500 habitants.
1.4. En déduire le volume maximal
d'eau disponible par habitant et par jour. Conclure.
9,7
103 / 500 ~19 L.
La consommation d'eau est assurée ; le lavage des mains et hygiène pour
la nourriture de base sont possibles. Pas ou peu de douches ; pas de
lessive.
2. Pertes
de charge le long de la canalisation.
Longueur de la canalisation horizontale : AB=250 m. Pression en A,
début de la canalisation : pA = 3,5 105 Pa.
2.1.
La différence de pression PA-PB, le débit deau D
et la résistance hydraulique de la canalisation R sont liés par la
relation :
D = (PA-PB ) / R.
On donne R = 1,0 108 Pa s m-3.
2.1.1. Montrer que PA-PB
= 4,5 104 Pa et et déduire PB.
PA-PB = D R = 0,45 10-3
x 1,0 108 = 4,5 104
Pa.
PB = PA -4,5 104 =3,5 105
-4,5 104 =3,05 105 Pa.
2.2. On souhaite diminuer la
différence de pression entre les points A et B tout en conservant le
débit constant.
2.2.1. Préciser
dans quel sens il faut faire varier la résistance hydraulique R.
A débit D constant, diminuer PA-PB revient à
diminuer la résistance hydraulique R.
2.2.2 Proposer une
modification de la canalisation permettant de répondre à cet objectif.
Diminuer la longueur de la canalisation ou augmenter son diamètre.
3. Rendre l'eau potable
grâce aux rayons solaires.
Les microorganismes présents dans l'eau sont détruits par les rayons UV
et le chauffage de l'eau par les rayons IR..
3.1.I ndiquer le domaine
des rayonnements UV et IR.

3.2. Expliquer le
rôle des rayons IR dans la désinfection de l'eau.
Les rayons IR chauffent l'eau. La désinfection par les UV à 50°C est
trois fois plus rapide qu'à 20°C.
3.3. Parmi les UV,
les rayons de longueur d'onde l
= 2,54 10-7 m sont les plus efficaces.
Calculer l'énergie associé à ce rayonnement.
E = hc / l =6,62
10-34 x3,00 108 /(2,54 10-7)=7,82 10-17
J.
L'énergie d'un photon IR est-elle supérieure ou inférieure à celle d'un
photon UV ? Justifier.
Les longueurs d'onde des photons IR sont supérieures à celle des
photons UV.
L'énergie des photons UV est donc supérieure à celle des photons IR.
|
...
|
....
|
Hygiène des mains. ( 7 points).
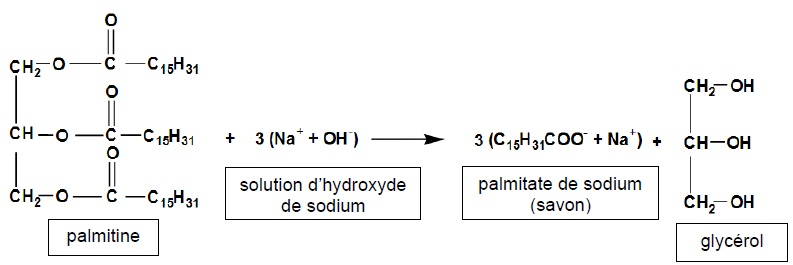
1. Fabrication d'un savon à partir de la palmitine et de l'hydroxyde de sodium concentré.
1.1. Nommer cette réaction. Préciser si elle est totale ou partielle.
La saponification est une réaction totale.
1.2. Identifier le triglycéride et nommer la fonction caractéristique présente dans cette molécule.
La palmitine compte trois fonctions ester.
1.3. L'acide palmitique C15 H31COOH est-ilsaturé ou insaturé ?
Une chaîne carbonnée saturée comptant 15 atomes de carbone, possède 15 x2 +1 = 31 atomes d'hydrogène.
L'acide palmitique C15 H31COOH est un acide gras saturé.
1.4. On mélange 500 kg de palmitine et un excès de solution d'hydroxyde de sodium afin de préparer du savon.
1.4.1. Montrer que la quantité de matière de palmitine est égale à 620 mol. M(palmitine) = 806 g / mol.
n = 500 x1000 / 806 ~620 mol.
1.4.2. Quelle est la quantité de matière de savon formé ?
3 x 620 =1,86 103 mol.
1.4.3 En réalité on recueille expérimentalement 1,70 103 mol de savon. Expliquer cette différence.
La réaction est totale, mais le rendement de chaque étape ( synthèse,
séparation du produit et purification) n'est pas égal à 100 %.
1.5. Dans un
laboratoire de chimie, la fabrication du savon peut s'effectuer dans un
montage de chauffage à reflux. Légender ce montage.
Chauffage
à reflux : 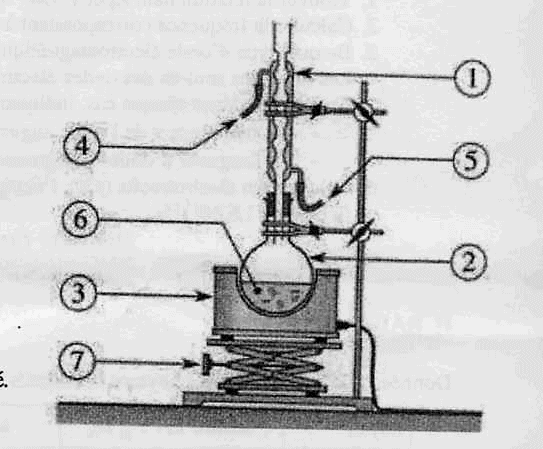
1 : réfrigérant à eau ; 2 : ballon ; 3 : chauffe ballon
; 4 : sortie de l'eau ; 5 : entrée de l'eau ; 6 :
mélange réactionnel (
huile + solution de soude alcoolique ) ; 7 : élévateur à croisillons.
2. Lavage des mains au savon.
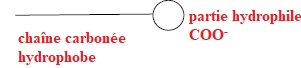
2.1. L'ion palmitate présente une partie hydrophile et une partie hydrophobe.
Identifier ces deux parties.
2.2.1. Pour
illustrer l'action des ions palmitate lors du lavage des mains,
schématiser quelques ions palmitate sur la couche de graisse.
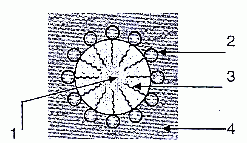
1 : huile
2 : partie hydrophile du tensioactif
3 : partie hydrophobe du tensio-actif
4 : eau.
2.2.2. Comment appelle -ton la goutte de graisse entourée d'ion palmitate ?
Une micelle.
2.2.3. Expliquer à quoi servent les étapes de frottage lors du lavage des mains.
Frotter pour bien répartir le savon sur les deux faces et entre les doigts.
La spiruline, micro algue séchée, réduite en poudre, contribue à lutter contre la malnutrition.
1. La phénylalanine est l'un des 8 acides aminés essentiels contenus dans la spiruline..
1.1. Entourer et nommer les deux groupes caractéristiques de cette molécule. Justifier le terme " acide a aminé".
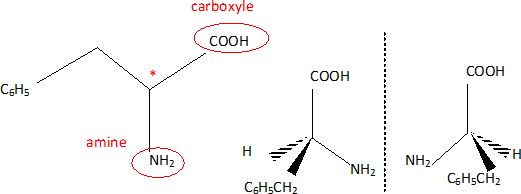
Le groupe amine et le groupe carboxyle sont portés par le même atome de carbone.
1.2. Définir un atome de carbone asymétrique.
C'est un atome de carbone lié à 4 atomes ou groupes d'atomes différents.
1.3 Justifier que la molécule de phénylalanine est chirale.
Une molécule chirale (
présence d'un carbone asymétrique, dans ce cas ) existe sous la forme
de deux énantiomères non superposables, image l'un de l'autre dans un
miroir plan.
1.4 Représenter en projection de Fischer la configuration L de la phénylalanine.
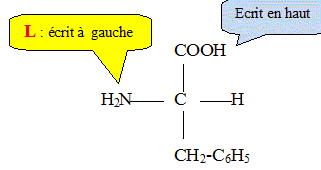
2. Après absorption
de la spiruline, les différents acides aminés peuvent réagir entre eux
pour former des dipeptides. Il se forme par exemple le dipeptide
Val-Phel.
Ecrire la réaction de synthèse de ce dipeptide et entourer la liaison peptidique.
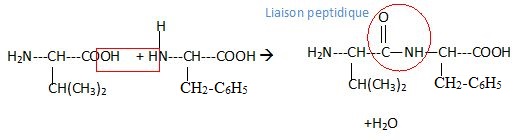
|
|