Pipistrel, un petit avion électrique,
cellule solaire à colorant, bac STL
2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
Pipistrel, un petit avion électrique.
1. Déterminer l'énergie disponible, en kWh, dans une batterie totalement chargée.
Tension nominale U = 340 V ; capacité énergétique maximale : Q =30 Ah.
Energie ( Wh) = Q U = 30 x340 = 10200 Wh = 10,2 kWh.
2. Citer un phénomène physique et un phénomène chimique pouvant être à l'origine d'un échauffement des batteries.
Phénomène physique : l'effet Joule.
Phénomène chimique : la réaction d'oxydoréduction libère de l'énergie.
3. La batterie est un convertisseur d'énergie. Décrire la conversion d'énergie mise en jeu dans une batterie lithium-ion.
L'énergie chimique stockée est convertie en grande partie en énergie
électrique. Une faible partie est convertie en énergie thermique.
4.
Indiquer les différents transferts d'énergie ayant lieu au niveau du moteur de l'avion alimenté par la batterie.
Le moteur reçoit de l'énergie électrique ; il la convertit en énergie mécanique et en énergie thermique.
Lors d'un vol, le moteur délivre une puissance de 60 kW au cours
du décollage, qui est réduite à 40 kW pendant la phase de montée, et
enfin à 20 kW lorsque l'altitude est stabilisée.
Après 25 minutes de vol, le pilote stabilise son altitude et l'énergie
disponible restante dans les deux batteries est de 59 %. Il ne faut
jamais décharger les batteries en dessous de 20 %.
5. Estimer la durée totale du vol. Comparer avec la durée moyenne du vol de formation ( 45 min).
Energie disponible restante dans les deux batteries : 2 x 10,2 x0,59 =12,036 kWh.
Limite à ne pas dépasser : 2 x10,2 x 0,20 =4,08 kWh.
Energie encore disponible : 12,036-4,08 =7,956 kWh.
Durée de vol correspondante à altitude stabilisée : 7,956 / 20 ~0,3978 h ou 23 min 52 s ~24 min.
Durée totale du vol : 25 +24 =49 min pratiquement égal à la durée du vol de formation.
6 Justifier le choix de la batterie lithium-ion pour les avions électriques.
Energie spécifique très importante 100 à 230 Wh kg-1.
Très grand nombre de cycle charge /décharge ( 2000).
On donne le schéma de la batterie lithium-ion durant la décharge.
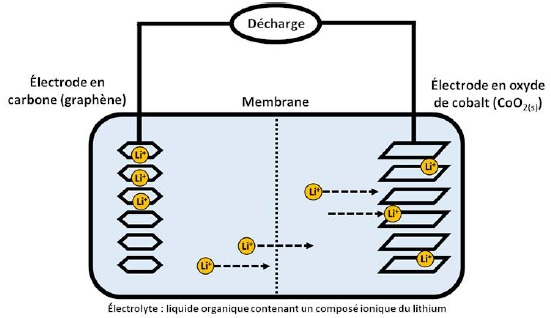
7. Déterminer le nombre d'oxydation de l'élément cobalt dans CoO2(s) et LiCoO2(s). En déduire l'oxydant et le réducteur dans le couple comportant ces deux espèces.
Le nombre d'oxydation de Li est +I et celui de O est : -II.
CoO2(s) : n.o(Co) +2 *(-II) = 0 ; n.o(Co) = +IV.
LiCoO2(s) : +I +n.o(Co)+2*(-II) = 0 ; n.o(Co)= +III.
CoO2(s) est l'oxydant et LiCoO2(s) est le réducteur.
8.a
Lors de la décharge, les atomes de lithium se transforment en cation
lithium, déterminer la quantité d'électricité maximale qui peut être
libérée par gramme de lithium. L'exprimer en C.
Capacité énergétique nominale d'une batterie 30 Ah = 30 x3600 =108 000 C.
Oxydation du lithium : Li --> Li+ +e-.
Quantité de matière d'électron : n =108 000 / 96500 =1,119 mol.
Quantité de matière de lithium correspondante : 1,119 mol.
M(Li) =6,94 g / mol.
1,119 / 6,94 = 0,161 mol par gramme de lithium.
0,161 x 96500 =15 562 C par gramme de lithium.
8.b. Montrer que 1 Ah = 3600 C et exprimer la charge électrique maximale libérée par 1 g de lithium en Ah.
Dans une heure, il y a 3600 s. 1 Ah correspond donc à 3600 C.
15 562 / 3600 =4,323 Ah libérés par 1 g de lithium.
8.c. Sachant que la
tension aux bornes de la batterie est de 3,6 V et que l'énergie stockée
dans les deux batteries est de 20 kWh, déterminer la masse de lithium
présente dans les deux batteries.
Energie( Wh) = tension ( V) x capacité énergétique ( Ah).
Capacité énergétique stockée dans les deux batteries :
20 103 / 3,6 = 5,556 103 Ah.
Masse de lithium : 5,556 103 / 4,323 =1,285 103 g = 1,285 kg.
|
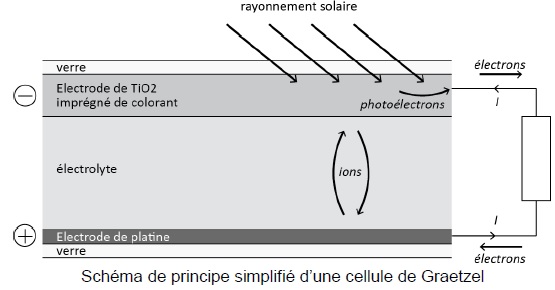
Cellule solaire à colorant.
Il
s'agit de cellules conçues pour convertir l'énergie solaire en
électricité. Elles sont constituées d'une électrode de titane TiO2
imprégné de colorant. Lorsqu'elle est éclairée, cette électrode libère
des électrons. Ceci génère un courant électrique dans le circuit
alimenté par la cellule.
Etude énergétique.
1. Compléter
le schéma suivant en indiquant la nature des transferts d'énergie et
pour chacun d'eux, faire figurer son sens à l'aide d'une flèche.
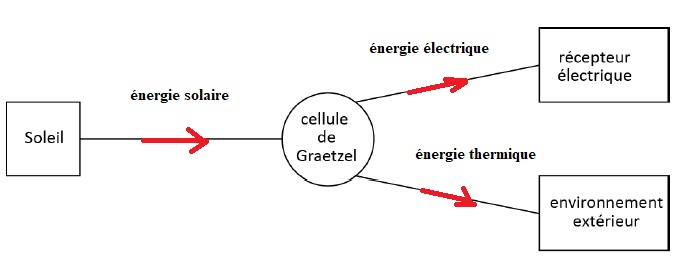
2. Citer le transfert qui correspond à une dissipation d'énergie.
Le transfert thermique.
3. Exprimer le rendement de cette cellule.
Rendement = puissance électrique disponible / puissance solaire reçue.
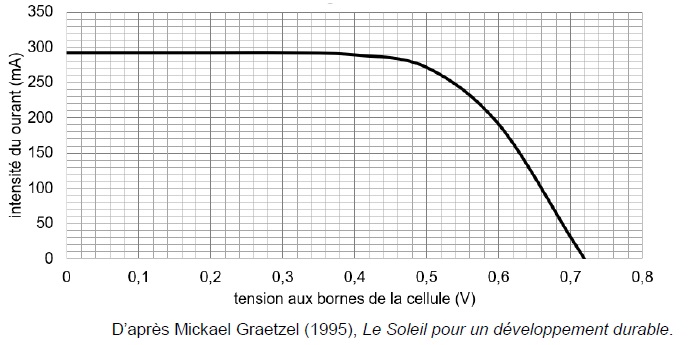
Pour un éclairement E = 96,4 mW cm-2, on a représenté la caractéristique intensité- tension de cette cellule.
4. Rédiger le prorocole expérimental permettant d'obtenir cette caractéristique intensité- tension.
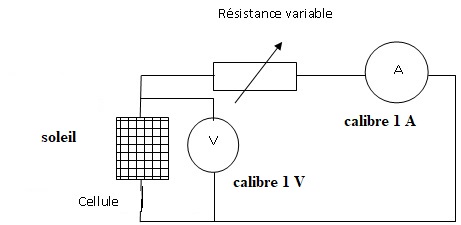
Faire varier la résistance variable ( rhéostat) et relever à chaque fois l'intensité et la tension.
5. Citer la relation permettant de déterminer Pélec à partir des valeurs obtenues. Déterminer la puissance électrique cédée lorsque la tension vaut 0,4 V.
Pélec = U I.
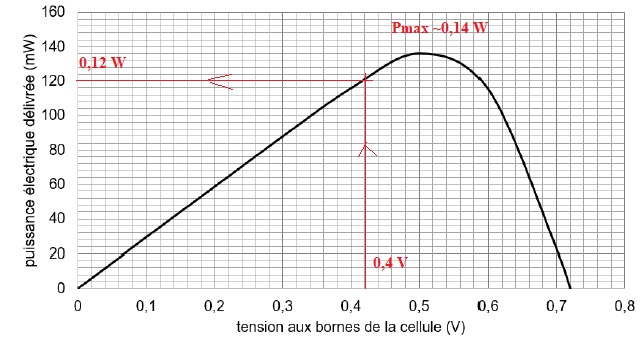
6. Déduire de cette étude le rendement de la cellule et commenter.
La cellule a les dimensions suivantes: 4 cm x 4 cm soit une surface de 4 x4 = 16 cm2.
Puissance solaire reçue par la cellule : 96,4 x16 = 1,54 103 mW = 1,54 W.
Rendement maximal = Puuissance électrique maximale / puissance solaire reçue = 0,14 / 1,54 ~0,09 (9 %).
Ce rendement est très faible, inférieur à celui d'une cellule photovoltaïque.
Pourquoi imprégné de colorant le dioxyde de titane ?
Le dioxyde de titane ne peut absorber un photon que si celui-ci possède une énergie supérieure à 3,7 eV.
7. Citer la relation entre longueur d'onde l, célérité c et fréquence n.
Déterminer à quelle condition sur la longueur d'onde, les photons d'un
rayonnement peuvent être absorbés par le dioxyde de titane. Conclure en
comparant aux ordres de grandeur des longueurs d'onde limites du
spectre visible.
l = c / n ;
Energie minimale du photon pouvant être absorbé : 3,7 x1,6 10-19 =5,92 10-19 J.
Fréquence correspondante : 5,92 10-19 / (6,63 10 10-34) = 8,93 1014 Hz.
Longueur d'onde maximale : 3,00 108 / (8,93 1014)=3,36 10-7 m = 336 nm. ( domaine U.V).
Cette longueur d'onde n'appartient pas au spectre visible [ 400 nm ; 800 nm ].
Pour pallier cet inconvénient du dioxyde de titane, ce dernier a été
imprégné d'un colorant. l'un d'eux est le N3-dye dont le spectre
d'absorption est reproduit ci-dessous.
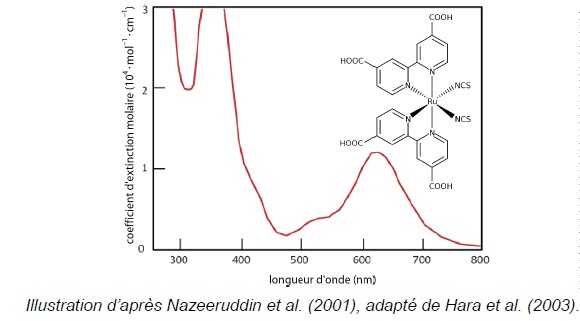
8. Déterminer à
quelle condition sur la longueur d'onde les photons d'un rayonnement
peuvent être absorbés par la "cellule à colorant" imprégné du N3-dye.
Justifier l'intérêt de déposer un tel colorant sur le dioxyde de titane.
Ce colorant présente un maximum d'absorption vers 650 nm, [600 nm ; 700 nm ]. Cette longueur d'onde appartient au spectre visible [ 400 nm ; 800 nm ].
A propos de l'électrolyte.
L'électrolyte est une solution de diiode et d'ion iodure ( couple oxydant / réducteur I2 / I-
). Un électrolyte est considéré comme stable au sein d'une cellule si
sa concentration ne diminue pas de plus de 2 % par an. Afin de tester
la stabilité de la solution aqueuse de diiode et d'ion iodure au sein
de la cellule, le protocole suivant est mis en oeuvre.
L'électrolyte est préparé par dissolution de 0,150 g de diiode solide I2 dans une solution d'iodure de potassium, pour atteindre un volume de 500 mL de solution.
Cet électrolyte est alors utilisé dans une cellule de Graetzel ;
Cette cellule est mise en fonctionnement, soumise à de fortes
températures et exposée à une lumière intense, conditions
expérimentales reconstituant un an de fonctionnement normal de la
cellule ;
la cellule est alors démontée et un échantillon de l'électrolyte est prélevé.
Dosage de l'électrolyte.
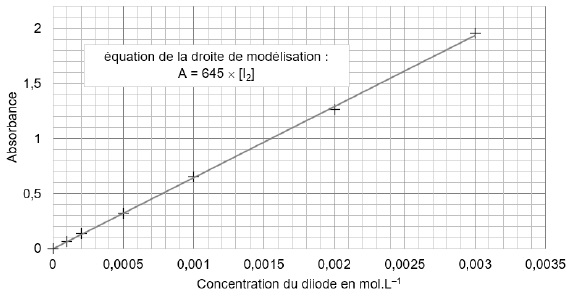
Les absorbances de 7 solutions étalons, de concentrations connues en diiode, sont mesurées à une longueur d'onde de 470 nm.
L'absorbance de l'échantillon d'électrolyte prélevé dans la cellule,
après sa mise en fonctionnement, est mesurée à la même longueur d'onde
que les solutions étalons. La valeur mesurée vaut A = 0,680. M(I2) = 253,8 g / mol.
9. Déterminer la valeur de la concentration initiale en quantité de matière c0 de diiode dissous dans l'électrolyte.
Quantité de matière diiode : n = masse / masse molaire =0,150 / 253,8 =5,91 10-4 mol.
Concentration c0 = n / V = 5,91 10-4 / 0,500 =1,182 10-3 mol / L.
10. L'électrolyte testé peut-il être considéré comme suffisamment stable pour être utilisé dans la cellule de Graetzel ?
A = 645 [I2] ; [I2] =0,680 / 645 =1,054 10-3 mol / L.
Ecart relatif : (1,182 -1,054) / 1,182 ~0,108 soit 10,8 %.
Cette valeur étant supérieure à 2 %, cet électrolyte ne peut pas être utilisé.
|
|







