Acide
lactique et le lactate d'éthyle. Bac gnéral Amérique du Nord 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
A. L'acide lactique.
A.1. identifier et nommer les familles fonctionnelles présentes dans la molécule.
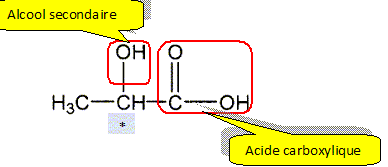
A.2. Représenter la formule topologique de l'isomère de position de l'acide lactique.
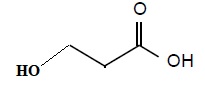
On souhaite mesurer le pKa du couple acide lactique / ion lactate.
On donne l'équation de la réaction modélisant la transformation acido-basique entre l'acide lactique et l'eau.
C3H6O3 aq + H2O(l) = C3H5O3-aq + H3O+aq.
A.3.
Identifier les couples acide-base mis en jeu.
C3H6O3 aq / C3H5O3-aq ; H3O+aq / H2O(l).
A.4. Montrer que la constante d'acidité Ka du couple acide lactique / ion lactate peut s'écrire :
Ka = [H3O+]2 /(C-[H3O+]. C° avec C° = 1 mol / L.
Ka = [H3O+] [C3H5O3- ] / [C3H6O3].
La solution est électrique ment neutre et HO- est négligeable en milieu acide.
[H3O+] =[C3H5O3- ].
Conservation de l'élément carbone : C = [C3H5O3- ] +[C3H6O3] ; [C3H6O3] = C-[C3H5O3- ] = C-[H3O+].
On mesure le pH d'une solution aqueuse d'acide lactique de concentration C = 8,00 10-3 mol / L. On trouve pH = 3,03.
A.5. Calculer la concentration en ion oxonium de cette solution.
[H3O+] = 10-pH = 10-3,03 = 9,33 10-4 mol/ L.
A.6 . Justifier que l'acide lactique n'est pas un acide fort.
[H3O+] < C , l'acide lactique est faible.
A.7. En déduire Ka.
Ka = [H3O+]2 /(C-[H3O+] = (9,33 10-4)2 /(8,00 10-3- 9,33 10-4 ) =8,7 10-7 / 7,07 10-3 =1,23 10-4.
On effectue une série de 12 mesures du pH de la solution d'acide lactique de concentration C = 8,00 10-3 mol/L.
Le traitement statistique des résultats aboutit à une valeur moyenne du pKa de 3,871667 avec une incertitude type de 0,026935.
A.8. Ecrire avec un nombre de chiffres significatifs, le résultat.
pKa moyen =3,87 ±0,03.
Le diagramme de distribution suivant du couple acide lactique / ion lactate est construit en utilisant pKa ref= 3,90.
. 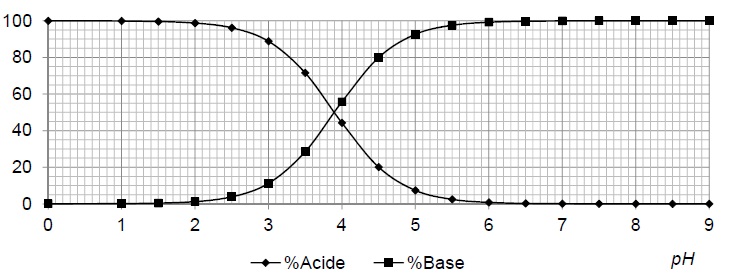
A.9. Expliquer et justifier la méthode permmettant de retrouver sur ce diagramme la valeur du pKa ref.
A pH = pKa, [C3H5O3- ] = [C3H6O3] = 50 % de la concentration initiale en soluté apporté.
pKa = abscisse du point intersection des deux courbes.
A.10. Comparer le résultat de la mesure avec la valeur de référence.
( pKa ref- pKa moyen ) / pKa ref =(3,9 -3,87) / 3,9 =7,7 10-3 ( 0,77 %).
|
....
|
Estérification de l'acide lactique.
C3H6O3 (l) + C2H6O(l) = C5H10O3(l) + H2O(l).
On étudie l'influence de différents paramètres sur cette transformation.
Expérience (a) : 0,741 mol d'acide lactique et 0,85 mol d'éthanol ; chauffage à 80°C.
Expérience
(b) : 0,741 mol d'acide lactique et 0,85 mol d'éthanol et
quelques gouttes d'acide sulfurique concentré ; chauffage à 80°C.
On suit l'évolution temporelle de la transformation par une succession de dosages à différents instants.
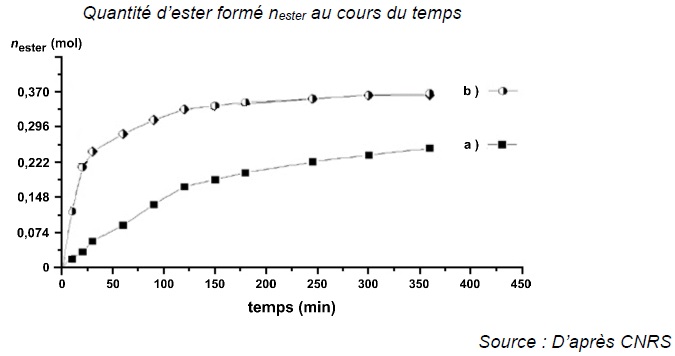
On note V le volume du milieu réactionnel supposé constant.
B.1. Exprimer la vitesse volumique d'apparition de l'ester.
v = 1 / V d nester /dt.
B.2. A partir de la courbe (b), indiquer l'évolution de la vitesse v d'apparition de l'ester.
La vitesse est proportionnelle au coefficient directeur de la tangente à la courbe à la date t..
Les tangentes sont de moins en moins inclinées par rapport à
l'horizontale. Leur coefficient directeur diminue au cours du temps.
La vitesse de la réaction diminue au cours du temps.
B.3. Quel est le rôle de l'acide sulfurique ?
L'acide sulfutique joue le rôle de catalyseur. L'équilibre est plus rapidement atteint mais sa composition reste inchangée.
B.4. Pour l'expérience (a) indiquer l'état final au bout de 350 min.
nester ~0,26 mol ; neau = 0,26 mol.
n acide lactique =0,741 -0,26 = 0,48 mol ; n éthanol = 0,85 -0,26 =0,59 mol.
|
|



