Décapage
d'une pièce en aluminium, Bac Amérique du Nord 2021.
Gaz parfait, titrage conductimétrique, titre massique.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
On étudie la préparation d'une solution d'acide chlorhydrique, puis son action lors du décapage d'une pièce en aluminium.
Préparation d'une solution d'acide chlorhydrique.
On
dissout un volume de 150 L de chlorure d'hydrogène gazeux HCl (
g) dans de l'eau pour obtenir 1,00 L de solution aqueuse d'acide
chlorhydrique.
Le chlorure d"hydrogène est assimilé à un gaz parfait et l'expérience
se déroule sous une pression atmosphérique de 1013 hPa et à une
température ambiante de 20 °C.
A.1. Ecrire l'équation de la dissolution du chlorure d'hydrogène dans l'eau.
HCl(g) + H2O(l) --> H3O+aq + Cl-aq.
A.2. Déterminer la concentration en quantité de matière de chlorure d'hydrogène apporté Cs de la solution S ainsi préparée.
Loi des gaz parfaits : n = PV / (RT).
P = 1,013 105 Pa ; V = 0,150 m3 ; T = 293 K.
n = 1,013 105 x 0,150 /(8,32 x293)=6,23 mol dans 1,00 L.
Cs = 6,23 mol / L.
Pour contrôler cette concentration, on procède à un titrage
conductimétrique par une solution aqueuse d'hydroxyde de sodium. Après
dilution de la solution précédemment obtenue, on met en oeuvre le
titage et on obtient le graphe suivant :
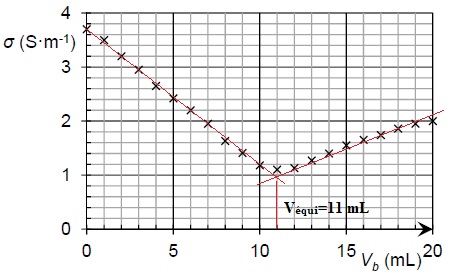
A.3 . Justifier l'évolution de la pente de la courbe au cours du titrage.
Avant l'équivalence, du point de vue de la conductimétrie, tout se passe comme si on remplaçait les ions oxonium par des ion Na+, de conductivité molaire bien moindre : la conductivité de la solution diminue.
Après l'équivalence, on ajoute des ions hydroxyde et des ions sodium : la conductivité de la solution croît.
B. Décapage à l'acide chlorhydrique.
Une
pièce d'aluminium de 350 g est décapée dans 1,00 L de solution
d'acide chlorhydrique. Une réaction a lieu à la surface, éliminant une
partie de l'aluminium qui passe en solution. Un dégagement gazeux
incolore et inflammable est observé.
On donne l'équation chimique modélisant cette réaction.
2Al(s) + 6H3O+aq --> 2Al3+aq +3H2(g) + 6H2O(l).
B.1. Indiquer si cette équation traduit une réaction acido-basique ou une réaction d'oxydoréduction. Justifier.
Réaction d'oxydoréduction :
oxydation de Al(s) en Al3+aq. (Al(s) --> Al3+ aq +3e-) ;
réduction de H3O+aq ( 2H3O+aq +2e- --> H2(g) + H2O(l)).
On souhaite que le décapage cesse lorsque 0,10 % en masse d'aluminium a réagi.
B.2. Déterminer la concentration, notée C, de la solution d'acide chlorhydrique à utiliser pour décaper correctement la pièce.
Masse d'aluminium ; 350 x 0,10 / 100 =0,35 g
Quantité de matière correspondante n = 0,35 / m(Al) = 0,35 / 27 ~ 0,013 mol.
Quantité de matière d'ion oxonium : 3 n = 3 x0,013 ~0,039 mol.
C = n/ V = 0,039 / 1 = 0,039 mol / L.
Le pourcentage massique d'une solution d'acide chlorhydrique est la
masse de gaz HCl dissous pour obtenir 100 g de solution. Ainsi 100 g de
solution d'acide chlorhydrique à 10 % ont été fabriqués en dissolvant
10 g de chlorure d'hydrogène.
On dispose d'une solution commerciale à 23 % en masse d'acide chlorhydrique.
La masse volumique de cette solution est r = 1,15 g / mL.
B.3. Déterminer la dilution à appliquer à la solution commerciale à 23 % pour décaper correctement la pièce.
La solution à 23 % a été fabriquée en dissolvant 23 g de chlorure d'hydrogène.
n(HCl )= 23 / M(HCl) =23 / 36,5 ~0,63 mol.
Volume de la solution : masse / masse volumique = 100 / 1,15 ~87 mL.
Concentration de cette solution : Cmère = n / V = 0,63 / 0,087 =7,25 mol / L.
Facteur de dilution F = Cmère / Cfille = 7,25 / 0,039 ~186.
|
