Chimie
(université Abdou Moumouni, Niamey), 06 /
2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
La vitamine C.
On notera AscH2, AscH-, Asc2- les différentes espèces acido-basiques dérivées de l'acide ascorbique.
Un comprimé de vitamine C contenant 8,8 mg d'acide ascorbique AscH2 ( M = 176 g / mol) est dissout dans 50 mL d'eau. Soit S1 la solution ainsi obtenue.
1.
Calculer la concentration de l'acide ascorbique dans la solution S1.
Quantité de matière n = 8,8 / 176 =0,05 mmol.
C =n / V =0,05 / 50 =1,0 10-3 mol / L.
L'acide
ascorbique est un diacide faible dont la seconde acidité est
négligeable devant la première. l'acidiité de cet acide se ramène à
celle d'un monoacide faible de pKa = 4,2.
2. Calculer le pH de cette solution S1.
pH = ½(pKa-log(C) =0,5(4,2 -log(10-3) =½(4,2 +3) = 3,6.
3. On ajoute dans cette solution S1, 50 mL d'une solution d'ascorbate de sodium AscH- ; Na+.
Le pH de la solution obtenue après mélange est de 4,2. Quelle est la
concentration de la solution d'ascorbate de sodium utilisée ?
pH = pKa ; [AH] =[A-] ; [ascorbate de sodium]= C =1,0 10-3 mol / L.
4. Quel volume de soude 0,1 mol/ L faut-il verser dans 50 mL de la solution initiale S1 pour obtenir une solution S3 de pH= 4,2.
Titrage de la solution d'acide ascorbique par la soude avec arrêt à la demi-équivalence.
A l'équivalence de ce titrage : 0,1 Véq = 50 x1,0 10-3 ; Véq = 0,5 mL.
½Véq = 0,5 x0,5 = 0,25 mL.
L'urate de sodium.
La goutte résulte de la précipitation de cristaux d'urate de sodium lors de la production excessive d'acide urique noté H2U.
1. L'acide urique
est secrété normalement dans les urines sous forme de sel monosodique
noté NaHU à raison de 450 mg par jour pour un volume de 1,5 L d'urine.
l'urate de sodium se dissocie totalement en solution. Qu'elle
concentration d'ion urate élimine-t-on journellement ?
NaHU ou NaHC5H2N4O3 : M =190 g / mol.
NaHU = Na+ + HU-.
Quantité de matière n = 0,45 / 190 =2,37 10-3 mol dans 1,5 L.
Concentration C = n / V = 2,37 10-3 / 1,5 =1,58 10-3 mol / L.
2. La solubilité de l'urate de sodium est 0,85 g / L au pH urinaire. Calculer le produit de solubilité de l'urate de sodium.
Ks = [Na+] [HU-] = s2.
s = 0,85 / 190 =4,47 10-3 mol / L.
Ks = (4,47 10-3)2 =2,00 10-5.
3. Certains
médicaments permettent une augmentation de l'élimination urinaire de
l'urate de sodium. A partir de quelle quantité d'urate de sodium
excrété par jour seront-ils contre-indiqués ?
Il faut éviter la précipitation de l'urate de sodium, cause de
goutte. La concentration massique d'urate de sodium doit rester
inférieure à 0,85 g / L soit dans 1,5 L d'urine : 0,85 x1,5 ~1,28
g / jour.
|
...
|
....
|
Chimie organique.
Deux molécules de propanone se condensent en milieu basique pour donner un produit A de formule brute C6H12O2.
1. Comment s'appelle cette réaction ?
Cétolisation.
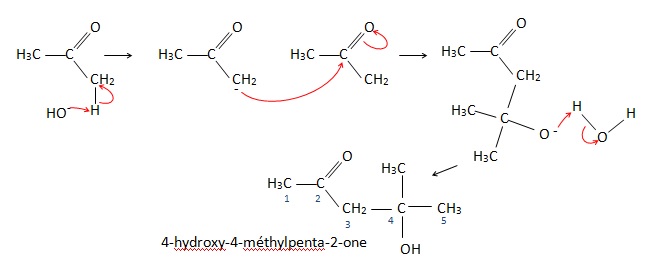
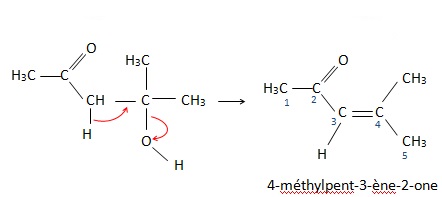
Le produit A se déshydrate en donnant un produit B de formule brute C6H10O.
2. Expliquer la réaction de formation de A à B. Nommer les composés A et B.
Alcools de formule brute C5H12O.
1. Ecrire les formules de ces alcools. Quels sont ceux qui sont optiquement actifs ?
CH3-CH2-CH2-CH2-CH2OH pentan-1-ol.
CH3-CH2-CH2-*CH(OH)-CH3 pentan-2-ol.
CH3-CH2-CH(OH)-CH2-CH3 pentan-3-ol.
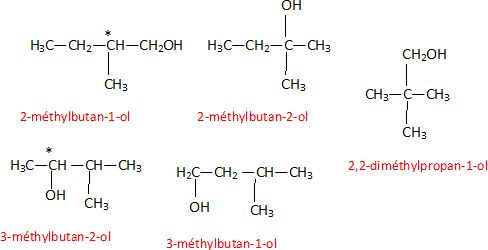
2. Quel alcool optiquement actif donne par oxydation par K2Cr2O7 en milieu acide , un composé de formule brute C5H10O2 ?
Un alcool primaire s'oxyde dans ces conditions en acide carboxylique. De plus il est optiquement actif.
Donc 2-méthylbutan-1-ol.
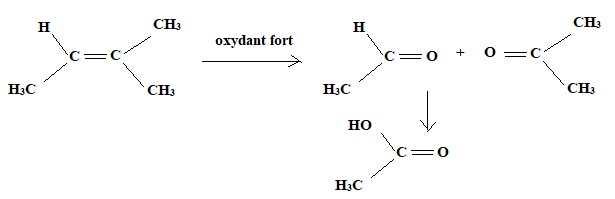
3. Quel est la formule développée de l'éthylénique qui fournit par action des oxydants forts de l'acide acétique et de l'acétone ?
La double liaison est rompue ; on obtient deux carbonyles ; un aldehyde peut s'oxyder en acide carboxylique.
|