Autour
de la molécule de CO2.
Concours agrégation interne 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
1. Quelques propriétés de la molécule.
1. Donner les configurations électroniques des atomes H(Z=1), C(Z=6) et O(Z=8). Que représente Z ?
Z est le numéro atomique ( nombre de protons du noyau).
H : 1 s1 ; C : 1s2 2s2 2p2 ; O : 1s2 2s2 2p4 .
2.
Enoncer les règles utilisées pour établir ces configurations
électroniques. Donner le numéro atomique de l'élément situé 4 lignes
sous le carbone dans la classification électronique.
Règle de Pauli : deux électrons se
d ifférencient par au moins l'un de leur nombres
quantiques n, l, m et s.
Règle de Klechkowski : l'ordre de
remplissage des orbitales se fait suivant (n+l) croissant ;
si deux orbitales atomiques ont le même nombre (l+n),
celle qui a la plus faible valeur de n est remplie en
premier ( principe de stabilité)
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f...
Règle de Hund : cas des orbitales de
mêmes énergie.
Les électrons de spins parallèles occupent
le maximum d'orbitales.
Pb ( Z = 82).
3. Donner la représentation de Lewis des molécules H2O, CO2 et CO. Expliquer pourquoi la molécule CO2 est linéaire.
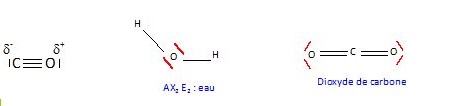
Chaque atome d'oxygène possèdent deux doublets non liants qui se
repoussent ; le minimum d'énergie est atteint lorsque les atomes
d'oxygène sont le plus éloigné possible. CO2 est une molécule linéaire.
4.
Un enseignant aborde avec ses élèves de seconde la partie "Molécules,
vers des entités plus stables chimiquement". Il envisage une séance
d'une heure à mener par groupe de 4 ou 5 élèves.
- Connaissances nécessaires pour aborder la séance :
Structure de l'atome , classification périodique des éléments.
- Problématique : les éléments chimiques les plus stables sont les gaz nobles ( dernière colonne de la classification périodique).
Comment les autres atomes vont-ils acquérir de la stabilité ?
- Ce que les élèves doivent retenir :
Les atomes ont deux possibilités pour acquérir la configuration électronique du gaz noble le plus proche :
- gagner ou perdre des électrons en formant des ions ;
- s'associer entre eux pour former des molécules.
Ils doivent alors respecter les règles suivantes :
règle du duet : les éléments de numéro atomique inférieur à 4 évoluent afin d'aquérir la structure de l'hélium ( 2 électrons externes) ;
règle de l'octet : les éléments de numéro atomique supérieur à 4 évoluent afin d'aquérir la structure délectronique du néon ( K2L8) ou de l'argon ( K2L8M8)
Pour former des molécules, les atomes forment des liaisons covalentes,
liaison formée de deux électrons, un électron étant donné par chaque
atome. Elle est schématisé par un trait " --".
Combien de liaisons de covalence peut former un atome ?
Le nombre de liaisons covalentes que peut former un atome est égal au
nombre d'électrons qu'il doit acquérir pour compléter sa couche externe
à 2 ou 8 électrons.
Modèle plus élaboré de la liaison chimique post-baccalauréat : modèle quantique, théorie des orbitales moléculaires.
5. Dans le monoxyde
de carbone, la longueur de la liaison CO est 112,8 pm. La molécule
présente un moment dipolaire de valeur µ = 0,110 D.
Déduire l'orientation du moment dipolaire ; déterminer le pourcentage
ionique de cette liaison. Quelle grandeur physique macroscopique du CO
gazeux est liée à l'existence du moment dipolaire ?
Le moment dipolaire est orienté de la charge négative vers la charge positive, du carbone vers l'oxygène.
µ = 0,110 x3,33 10-30 = 3,663 10-31 C m ;
% de caractère ionique : µ /(edCO) =3,663 10-31 /(1,6 10-19 x112,8 10-12) =0,020 ( 2,0 %).
CO est un excellent ligand et sa solubilité dans l'eau est faible.
2. Spectroscopie infra-rouge.
6. Que vaut le moment dipolaire électrique de la molécule CO2 ? Les modes normaux de vibration de la molécule CO2 sont représentés ci-dessous. Expliquer pourqui il y en a quatre. Quels sont ceux actifs en IR ?
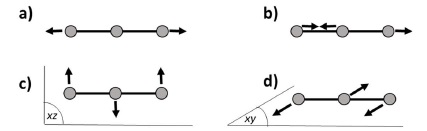
Du fait de sa symétrie, le moment dipolaire de la molécule de dioxyde de carbone est nul.
a) vibrations d'élongation symétriques.
b) vibrations d'élongation antisymétriques : les atomes d'oxygène
ont des mouvements dans le même sens, contrairement au mouvement du
carbone.
d) vibrations de déformation d'angle dans le plan ; les atomes
d'oxygène ont des mouvements dans le même sens contrairement au carbone.
c) vibrations de déformations d'angle hors du plan.
Un mode de vibration est actif en IR si le moment dipolaire de la
molécule varie au cours des vibrations. C'est le cas des modes b), c)
et d).
On donne le spectre IR de CO2 à l'état gazeux.
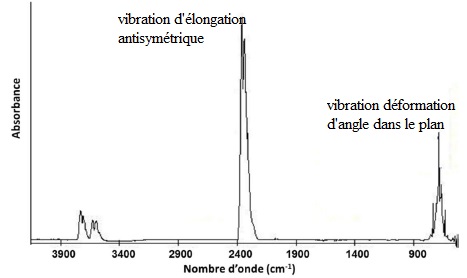
7.
Préciser ce que représente la grandeur portée en abscisse. Déterminer
la longueur d'onde des rayonnements absorbés. Quel est le mode le plus
énergétique ? Commenter.
Le nombre d'onde est l'inverse d'une longueur d'onde.
2350 cm-1 correspond à 1 / 2350 ~4,25 10-4 cm = 4,25 µm.
700 cm-1 correspond à 1 / 700 ~1,49 10-3 cm = 14,3 µm.
A la plus petite longueur d'onde correspond le mode le plus énergétique.
8. A partir du spectre IR d'un échantillon gazeux, peut-on déterminer la concentration du CO2
présent ? Si oui, quelle serait la loi à utiliser et quels sont les
paramètres à connaître pour faire cette détermination ?
L'absorbance A, proportionnelle à la concentration, permet de déterminer la concentration en CO2.
A = e l c avec l : épaisseur de la cuve en cm ; c : concentration en mol / L et e en L mol-1 cm-1, une caractéristique de la molécule.
9.
On donne les spectres du corps noir à deux températures ( 5800 K,
température de surface du soleil et 288 K température moyenne à la
surface de la terre ).
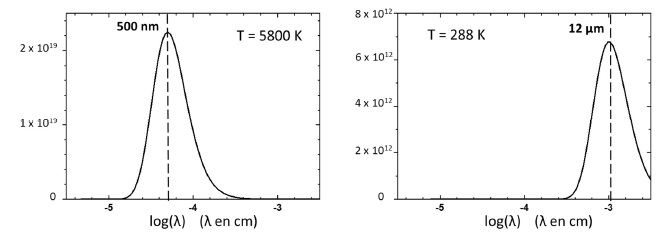
Expliquer en quelques lignes l'effet de serre atmosphérique.
Lorsque
le rayonnement solaire atteint l'atmosphère terrestre, 28 % est
réfléchi dans l'espace par l'air, les nuages et les surfaces claires de
la terre. Les rayons incidents non réfléchis sont absorbés par les
nuages ( 21 %) et la surface terrestre ( 51 %). La terre restitue cette
chaleur, la nuit et en hiver sous forme de rayons infrarouges Ce
rayonnement est absorbé par les gaz à effet de serre puis réémis dans
toute les directions, notamment vers la terre. Ce dernier créé l'effet
de serre.
10.
Pourquoi le dioxyde de carbone est-il particulièrement efficace
dans cet effet de serre ? Quel mode de vibration intervient
notamment ?
Le dioxyde de carbone gazeux présente un maximum d'absorption vers 12 µm ( vibration de déformation d'angle dans le plan).
11. Citez deux autres gaz à effet de serre dans l'atmosphère. Pourquoi O2 et N2 ne jouent-ils pas de rôle significatif dans cet effet de serre ?
H2O et CH4 contribuent à l'effet de serre. Les molécules O2 et N2 n'ont pas la capacité de vibration dans le domaine des infrarouges.
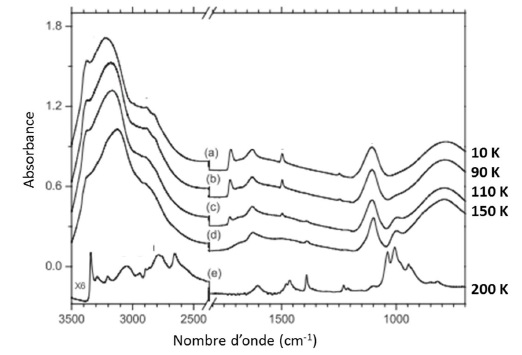
Afin de montrer la formation possible d'aminométhanol, un mélange de glace composé d'H2O, NH3 et H2CO
est condensé sur une paroi froide à très basse température ( 10 K). La
température est progressivement augmentée et le système est suivi par
spectroscopie IR.
12. La fiche de sécurité du méthanal comporte trois pictogrammes. Que signifient -t-ils ?

13. Quel est l'autre nom d'une solution aqueuse de méthanal ? Quelles précautions faut-il prendre lors de sa manipulation ?
Le formol.
Port de gants lunettes et vêtement de protection. Tenir à l'écart des matières combustibles.
14. Représenter la
formule semi-développée d'aminométhanol. Ecrire la réaction conduisant
à sa formation à partir des réactifs utilisés. A quelle classe de
réactions appartient-elle ?
H2N-CH2-OH.
NH3 + H2CO --> H2N-CH2-OH.
Addition sur la double liaison C=O.
15. Proposer un mécanisme réactionnel lorsqu'on réalise cette réaction en milieu aqueux à 298 K.
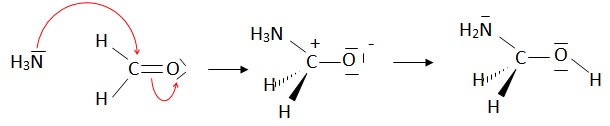
16. A partir de
l'évolution des températures des spectres IR d'une glace formée d'eau,
d'ammoniac et de méthanal, quelles informations permettent de penser
que l'aminométhanol a été formé lors de l'augmentation de température ?
Présence d'une bande fine vers 3350 cm-1 ( -NH2), d'une bande vers 1000 cm-1 ( C-O /C-N) ; disparition de la bande large vers 1725 cm-1 ( H2CO).
17. A partir de
quelle température observe-t-on cette formation ? Peut-on penser que la
transformation du méthanal est totale à 200 K ?
A partir de 90 K, la formation d'aminoalcool a lieu. A 200 K, la transformation est totale
18. Quelle autre méthode analytique pourrait-on utiliser pour démontrer la formation d'aminométhanol ? Justifier.
19. Dans certaine
conditions, l'aminométhanol peut subir une réaction de déshydratation.
Ecrire la réaction. A quelle classe de composé appartient le produit
formé ?
H2N-CH2-OH --> HN=CH2 + H2O. Il se forme une imine.
|
...
|
....
|
3. Etude cinétique suivie par spectroscopie IR.
Loi de vitesse v = k[NH3]2[H2CO]
20. Définir
cette vitesse de réaction à partir de la concentration des réactifs et
des produits. Quelle est l'unité de la constante k ?
v = dx/dt avec x avancement volumique.
v = -d[NH3] /dt ; v = -d[H2CO] /dt ; v = d[H2N-CH2-OH] / dt.
k s'exprime en mol-2 L2 s-1.
21. Préciser
l'ordre global de la réaction ainsi que les ordres partiels. La
réaction de formation de l'aminométhanol peut-elle être considérée
comme un acte élémentaire de Van't Hoff ?
ordre global : 3 ; ordres partiels 2 pour NH3 et 1 pour H2CO.
La
réaction de formation de l'aminométhanol ne peut pas être considérée
comme un acte élémentaire de Van't Hoff car l'ordre partiel par
rapport à NH3 n'est pas égal à son nombre stoechiométrique.
22.
Dans un expérience à 90 K, l'ammoniac est en large excès par rapport au
méthanal. La cinétique est suivie par spectroscopie IR à 1725 cm-1. Montrer que dans ce cas, la loi de vitesse peut s'écrire v = k'[H2CO]
et déterminer la loi d'évolution de la concentration de méthanal au
cours du temps. Exploiter les données obtenues pour déterminer k'.
temps (h)
|
0,08
|
0,50
|
1,00
|
1,50
|
2,00
|
3,00
|
4,00
|
5,00
|
6,00
|
7,00
|
8,00
|
9,00
|
Absorbance A
|
0,150
|
0,112
|
0,096
|
0,076
|
0,062
|
0;038
|
0,024
|
0,016
|
0,011
|
0,007
|
0,005
|
0,003
|
-ln(A)
|
1,897
|
2,19
|
2,34
|
2,58
|
2,78
|
3,27
|
3,73
|
4,14
|
4,51
|
4,96
|
5,30
|
5,81
|
(ln(A)-1,897) / t( h-1)
|
xxx
|
0.58
|
0,44
|
0,45
|
0,45
|
0,46
|
0,46
|
0,45
|
0,44
|
0,44
|
0,43
|
0,43
|
[NH3] ~ constante ; v = k[NH3]2[H2CO] = k' [H2CO].
v = - d[H2CO] /dt = k' [H2CO].
d[H2CO] / [H2CO] = -k'dt.
ln[H2CO] = -k't + Cste.
k' ~0,45 h-1 soit 0,45 / 3600 =1,2 10-4 s-1.
23. Rappeler la loi
d'Arrhénius et la signification des paramètres qui y interviennent.
Déterminer l'énergie d'activation de la réaction et commenter.
k = A exp(-Ea / (RT)) ou ln k = lnA -Ea / (RT).
k constante de vitesse ; T : température (K) ; R constante des gaz parfaits ( J mol-1 K-1) ; Ea : énergie d'activation ( J).
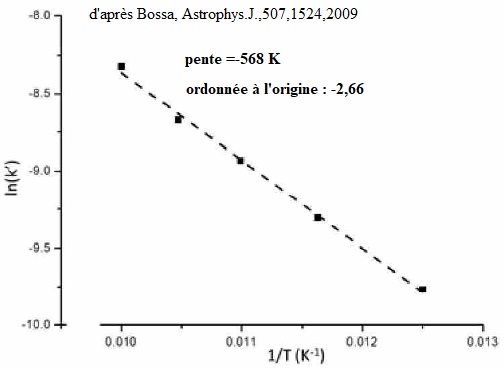
Pente -Ea / R =-568 ; Ea = 568 x 8,314 ~4,7 kJ.
Cette énergie d'activation est très faible. La réaction est rapide.
|
|