1. Le CO2 à l'état solide.
43.
Préciser l'état du dioxyde de carbone dans les régions 1 à 4 du
diagramme de phases. Définir ce qu'on appelle point triple et point
critique.
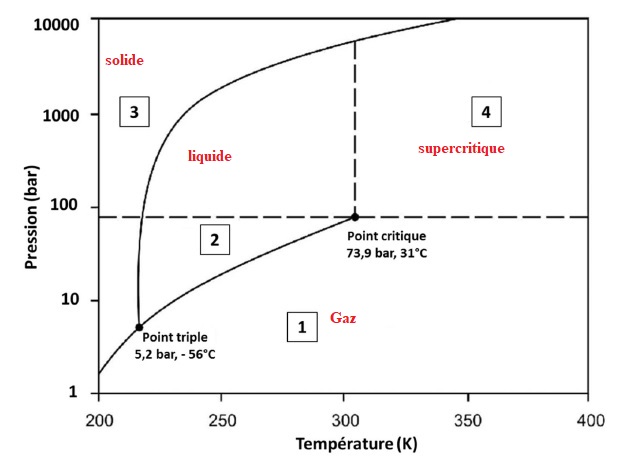
A point triple, les trois états, gaz, liquide et solide coexistent en équilibre.
Au dessus de la température critique ( au dessus de la pression
critique) on ne peut pas observer de changement d'état liquide-gaz.
44. Peut-on obtenir du CO2 liquide à partir du CO2 solide sous une pression de 1 bar ? Pourquoi dit-on que la carboglace est une glace séche ?
Le CO2 ne peut pas se trouver à l'état liquide sous une
pression de 1 bar. La carboglace passe directement à l'état gazeux,
elle se sublime.
45.
A l'état solide, le dioxyde de carbone cristallise dans la structure
cubique à face centrée ( cfc), les noeuds du réseau étant occupés par
les atomes de carbone. Représenter cette maille. Combien y a t-il de
molécules CO2 par maille ?. La masse de la carboglace est de 1562 kg m-3.
En déduire le paramètre de la maille cristalline et la distance entre
les atomes de carbone les plus proches. Comparer à la liaison C-O dans
la molécule CO2 ( 116,3 pm).
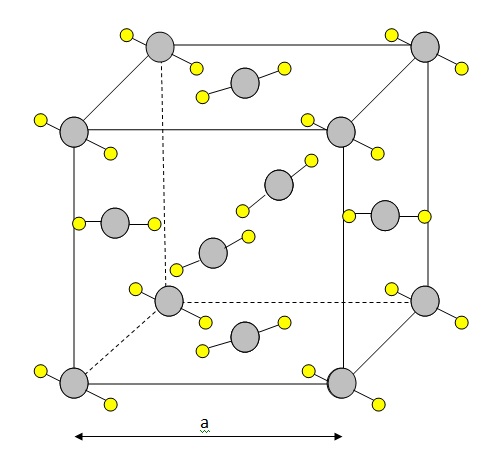
Chaque
atome de carbone situé au centre d'une face, donc commun à deux mailles
compte pour ½ : il y a 6 faces soit 6*0,5 = 3 atomes.
- Chaque atome situé à un sommet, donc commun à huit mailles compte pour 1/8 : il y a huit sommets donc 8 /8 atome.
Total : 4 molécules CO2 par maille.
Masse d'une maille : 4 M(CO2) / NA =4 x0,044 / (6,02 1023)=2,92 10-25 kg.
Volume d'une maille : a3 ; masse volumique : 1562 = 2,92 10-25 /a3 ; a = 5,72 10-10 m =572 pm.
Rayon d'un atome de carbone : r = 202 pm ; distance entre deux atomes de carbone les plus proches : 572-2 x202 =168 pm.
Cette valeur est supérieure à la liaison C=O dans la molécule CO2.
46. Préciser quels types d'interactions assurent la cohésion du cristal de CO2.
La cohésion est assurée par des interactions faibes de Van Der Waals.
47. En
classe de quatrième, un professeur mêne avec ses élèves une étude
expérimentale de l'évolution de la température de l'eau
pure pendant la solidification. Un graphique des mesures réalisées est
construit et exploité.
Rédiger un protocole expérimental.
Placer un tube à essais, contenant de l'eau distilée dans le mélange réfrigérant glace + sel.
Observer le contenu du tube est relever la température toutes les minutes.
temps (min
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
température (°C)
|
13
|
8
|
3
|
1
|
0
|
0
|
0
|
0
|
-1
|
-3
|
état de l'eau
|
L
|
L
|
L
|
L
|
L+S
|
L+S
|
L+S
|
L+S
|
S
|
S
|
Tracer le graphique de la température de l'eau en fonction du temps écoulé et conclure.
2. Production de la caféine.
A l'état de fluide supercritique, le CO2 est très utilisé
pour isoler et extraire des composés fragiles ( principes actifs)
d'un mélange. ( décaféination du café). Les faibles températures mises
en oeuvre ( 40 à 60 °C) permettent de conserver l'intégralité des
molécules thermolabiles. A la dépressurisation, le CO2 est libéré sous forme gazeuse et le composé recherché sous forme liquide ou solide.
48. Définir ce qu'est l'extraction par percolation. Donner un avantage d'une extraction par CO2 supercritique par rapport aux procédés classiques d'extraction par solvants ou hydrodistillation.
Percolation : extraction par passage du solvant ( eau) à haute pression.
Une extraction par CO2 supercritique n'utilise pas de solvants organiques, pas de fortes température et ne génère pas d'effluents.
49. A partir de la
synthèse de la caféine, écrire l'équation de la réaction chimique
correspondant à l'étape de passage du composé 3 au composé 4. Préciser
les produits formés.
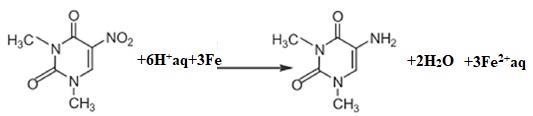
50.
Proposer un mécanisme réactionnel correspondant à la première partie du
traitement ( HCOOH / chauffage ) dans l'étape de passage du composé 4
au composé 5.
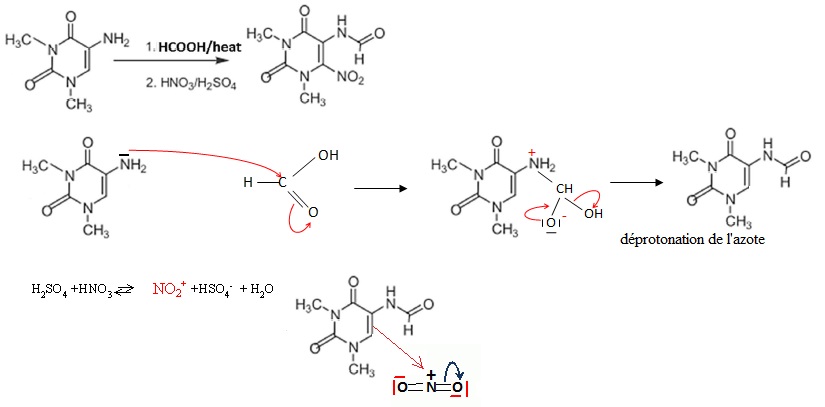
51.
Proposer un mécanisme réactionnel correspondant à la seconde partie du
traitement de l'étape de passage 4 à 5. Donner son mécanisme sur une
représentation simplifiée.
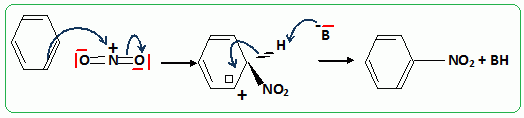
52. Le détail du protocole utilisé dans l'étape de 5 à 6 est décrit ci-dessous :
La cyclisation
intramoléculaire du composé 5 est réalisée en utilisant du fer et
l'acide acétique. 2 mL d'acide acétique glacial et 10 équivalent de
poudre de fer ( 0,30 g) sont mélangés à 100 mg du composé 5. le mélange
est porté à reflux pendant 30 min.
Proposer un protocole permettant, en fin de réaction, d'extraire et purifier la théophyline (6) du mélange réactionnel.
La théophyline est dissoute dans un solvant organique chloré ; ce dernier est éliminé par distillation.
Purification par recristallisation.
53.
Dans la dernière étape de passage de la théophyline à la caféine, le
diméthylsulfoxyde (DMSO) est utilisé comme solvant. Préciser la
structure de la molécule de DMSO et et déduire quelles propriétés de ce
solvant sont recherchées ici.
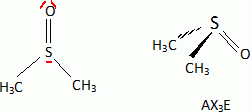
Solvant
polaire aprotique. Il est soluble à la fois dans l'eau et dans la
plupart des solvants. Il solubilise de nombreux composés organiques et
certains composés inorganiques.
54. Un enseignant (
classe de première générale) fait travailler à ces élèves la
capacité " déterminer la composition de l'état final d'un système
siège d'une transformation chimique totale". Réaction du 1,3 Diméthyl-
5-nitroouracyle avec le fer.

A + C + B --> D +E +F

Indiquer
la ligne de programme traduisant la relation de stoechiométrie utilisée
par la suite dans le code. Proposer une suite à ce programme qui permet
de donner la composition du système en fin de transformation considérée
comme totale.
Ligne 5 : coeficients stoechiométriques des réactifs.
Ligne 16 : A = ni_A-n_stoe_A # quantité de matière du réactif A en excès
D = ni_A-n_stoe_A # quantité de matière du produit D
F=ni_B # quantité de matière d'ion fer (II).
Ligne 21 : B=ni_B-n_stoeB # quantité de matière de fer en excès
D =ni-B # quantité de matière du produit D
F =3*ni_B # quantité de matière d'ion fer (II)
Ligne 23 ajouter : D =ni-A " quantité de matière du produit D
F = ni-B " quantité de matière d'ion fer (II)
|