Concours
ATRF 2019, préparateur-trice en physique et chimie.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
......
.....
|
L'acide sulfamique.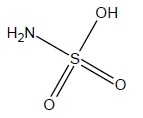
1.1 Quelle est la formule brute de l’acide sulfamique ?
NH3SO3.
1.2 Donner le nom des éléments chimiques composant l’acide sulfamique.
H : hydrogène ; N : azote ; S : soufre ; O : oxygène.
1.3. L’isotope majoritaire d’un de ces éléments chimiques s’écrit 168O . Donner la composition de cet atome.
e protons et 8 électrons ; 16-8 = 8 neutrons.
1.4. Calculer la masse molaire moléculaire de l’acide sulfamique.
M = 14 +3 +32,1 +3x16 = 97,1 g / mol.
1.5. Écrire l’équation de la réaction de l’acide sulfamique avec l’eau (on notera l’acide sulfamique AH pour simplifier).
AH aq + H2O (l) --> A-aq +H3O+aq.
1.6 Comment appelle-t-on le groupement NH2 qui apparaît notamment dans la molécule d’acide sulfamique ?
Groupe " amino".
II Etalonnage d'une solution titrante d'hydroxyde de sodium.
1.1. Quel est le nom courant donné à l’hydroxyde de sodium ?
Soude.
1.2. Pour quelle raison faut-il étalonner une solution d’hydroxyde de sodium avant son utilisation ?
La solution d'hydroxyde de sodium fixe le dioxyde de carbone de l'air :
elle se carbonate. Sa concentration en ion hydroxyde change.
On souhaite déterminer précisément la concentration molaire d’une
solution d’hydroxyde de sodium à l’aide d’une solution titrée d’acide
chlorhydrique . Cette solution a été préparée à partir d’acide
chlorhydrique commercial dont on donne quelques informations :
M = 36,46 g / mol ; densité d = 1,18 g / cm3 ; 37 %.
1.3 Que signifient les pictogrammes présents sur l’étiquette ?
Danger, solution corrosive.
1.4 A quoi correspondent les lettres H et P ?
Mentions de danger et conseils de prudence.
1.5 Quels EPI et/ou EPC faut-il prendre pour manipuler cette solution commerciale ?
Port de gants, blouse et lunettes de protection.
1.6 Calculer la concentration molaire de la solution commerciale.
Masse de 1 L de solution : 1,18 kg.
Masse d'acide chlorhydrique pur dans cette solution : 1,18 x 0,37 =0,4366 kg = 436,6 g.
Quantité de matière d'acide dans un litre C = 436,6 / 36,46 ~11,97 mol / L.
1.7 Quel volume de
cette solution commerciale doit-on prélever pour préparer 500,0 mL
d’une solution de concentration molaire 0,100 mol.L-1 ?
Facteur de dilution F = 11,97 / 0,100 = 119,7.
Volume de solution mère à prélever : 500,0 / 119,7 ~4,2 mL.
1.8 Comment appelle-t-on cette opération ?
Dilution.
1.9 Décrire (en 5 lignes maximum) le protocole pour préparer cette solution.
Prélever à l'aide d'une burette graduée ou d'une pipette jaugée 4,2 mL de solution mère.
Verser dans une fiole jaugée contenant 1 / 3 d'eaau distillée.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Boucher et agiter pour rendre homogène.
1.10 Indiquer dans
chaque cas s’il est possible de stocker le flacon d’acide chlorhydrique
commercial avec les produits chimiques suivants.
Clorure de sodium solide. Oui.
Ammoniaque 25 %. Non. ( réaction acide base exothermique).
Cuivre en poudre. Oui. ( ce métal n'est pas attaqué par cet acide ).
Dans un cahier de laboratoire, on trouve le protocole suivant « Prélever un volume Vhydroxyde=10,0 mL. Ajouter quelques
gouttes d’indicateur coloré. Doser par la solution d’acide chlorhydrique . Faire 3 dosages concordants ».
1.11 Citer une raison de faire 3 dosages concordants.
Afin d'obtenir un résultat avec une bonne précision.
1.12 Choisir l’indicateur coloré le plus adapté pour ce dosage. On justifiera rapidement la réponse.
Lors d'un dosage d'un acide fort par une base forte, le pH du point
équivalent est égal à 7. La zone de virage de l'indicateur coloré doit
contenir la valeur pH = 7. Donc le bleu de bromothymol.
1.13 Le virage de l’indicateur coloré est obtenu pour un volume équivalent de Veq= 12,50 mL. En déduire la concentration molaire en hydroxyde de sodium.
A l'équivalence CB VB = CA Véq ; CB =12,50 x 0,100 / 10,0 =0,125 mol/ L.
1.14 Citer une base forte autre que l’hydroxyde de sodium.
Hydroxyde de potassium KOH.
|
...
|
|
|
....
|
III. Dosage de l'acide sulfamique.
Un
enseignant souhaite proposer à ses élèves le titrage d’un détartrant,
l’acide sulfamique, par une solution titrante d’hydroxyde de sodium de
concentration molaire 1,25x10-1 mol.L-1 . Il souhaite mettre en place un suivi pH-métrique de ce dosage.
1.1 Dans la liste suivante, quelle(s) électrode(s) faut-il choisir ? Entourer la(les) bonne(s) réponse(s)
platine ; combinée ; sulfate mercureux cuivre.
1.2 Pour son essai,
l’enseignant demande que l’ensemble du montage soit prêt à être
utilisé. En 5 lignes maximum, décrire comment préparer le pH-mètre pour
qu’il soit directement opérationnel.
Plonger la sonde dans une solution tampon de pH = 7. Régler le bouton de température pour que le pH-métre affiche 7.
Sortir la sonde, la rincer à l'eau distillée et l'essuyer avec du papier Joseph.
Plonger la sonde dans une
solution tampon de pH = 4 ( ou 11 pour faire des mesures en milieu
basique) . Régler le bouton d'étalonnage pour que le pH-métre affiche 4.
Sortir la sonde, la rincer à l'eau distillée et l'essuyer avec du papier Joseph.
1.3 Dessiner le schéma annoté du montage expérimental de titrage.
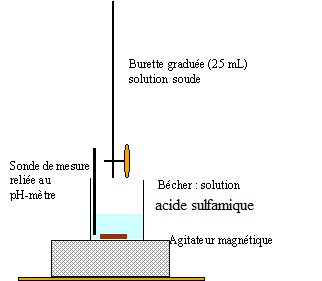
1.4 Entourer la représentation graphique qui correspond à ce dosage.
1.5 Préciser les grandeurs portées sur les axes de la représentation choisie.
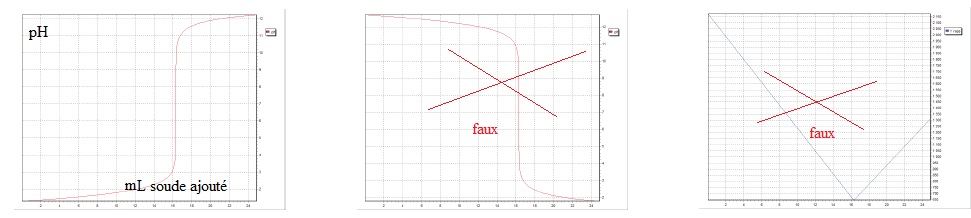
Une solution SA est préparée en dissolvant 1,0 g de poudre
de détartrant dans une fiole jaugée de 100,0 mL. Le dosage de 20,0 mL
de cette solution A nécessite une volume d’hydroxyde de sodium Vhydroxyde=16,30 mL pour obtenir l’équivalence.
1.6 Écrire l’équation du dosage.
NH2SO3H aq + HO-aq --> NH2SO3-aq +H2O(l).
1.7 Déterminer la concentration molaire en acide sulfamique dans la solution SA.
A l'équivalence CB Véq = CA VA ; CA =0,125 x16,3 / 20,0 =0,102 mol/ L.
1.8 Vérifier que la masse d’acide sulfamique contenue dans la solution SA vaut macide=0,99 g.
0,0102 mol dans 100,0 mL, dans 1,0 g de comprimé.
M(NH2SO3H) =97,1 g / mol.
0,0102 x 97,1 =0,989 ~0,99 g.
1.9 En déduire le pourcentage massique d’acide sulfamique dans la poudre.
0,99 / 1 x100 = 99 %.
IV. Synthèse d’un conservateur.
L’acide benzoïque est un conservateur alimentaire (E210). On peut le
synthétiser par oxydation de l’alcool benzylique en présence de
permanganate de potassium.
1 Montage expérimental
Pour cette synthèse, on utilise le montage ci-dessous.
1.1 Légender ce montage et indiquer le sens de circulation de l’eau de refroidissement.
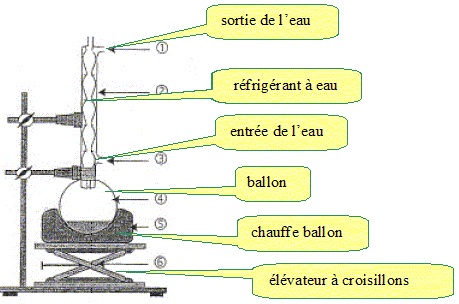
1.2 Quel est l’intérêt d’utiliser un montage de chauffage à reflux ?
On accélère la réaction ( la température est un facteur cinétique) tout
en évitant les pertes de matière ; les vapeurs se condensent dans le
réfrigérant et retombent dans le milieu réactionnel.
1.3 Dans un protocole, il est indiqué d’ajouter quelques grains de pierre ponce : pour quelle raison ?
Les grains de pierre ponce régularise l'ébullition.
1.4. Dans la salle de TP, on trouve plusieurs pictogrammes. Indiquer pour chacun deux sa signification :

|
2 Réaction de synthèse.
On verse goutte à goutte la solution de permanganate de potassium dans
le ballon contenant l’alcool benzylique : une couleur marron, due au
dioxyde de manganèse MnO2, apparaît au cours de la réaction.
2.1 Compléter les demi-équations relatives aux couples MnO4- (aq) / MnO2 (s) et C6H5CO2-(aq)/ C6H5–CH2OH (aq) en milieu basique à l’aide des bons nombres stoechiométriques.
4 fois {MnO4- (aq) +3e- +2H2O --> MnO2 (s)+ 4HO-aq.}
3 fois { C6H5–CH2OH (aq) +5HO-aq--> C6H5CO2-(aq)+ 4e- +4H2O.}
2.2 En l’expliquant, vérifier que la réaction qui a lieu s’écrit (en milieu basique) :
4MnO4- (aq) +12e- +8H2O +3C6H5–CH2OH (aq) +15HO-aq--> 4MnO2 (s)+ 16HO-aq +3C6H5CO2-(aq)+ 12e- +12H2O.
Simplifier : 4MnO4- (aq) +3C6H5–CH2OH (aq) --> 4MnO2 (s)+ HO-aq +3C6H5CO2-(aq) +4H2O.
Le ballon contient initialement 2,0 mL d’alcool benzylique en milieu basique (on rajoute 20 mL d’hydroxyde de sodium à 2 mol.L-1)
; l’ampoule de coulée contient un volume V=120 mL d’une solution de
permanganate de potassium de concentration molaire C=0,25 mol.L-1.
2.3 Calculer les quantités de matière initiales en ion permanganate et en alcool benzylique.
Données : masse volumique alcool benzylique 1,04 g.cm-3 ; masse molaire alcool benzylique : 108,1 g.mol-1.
n(alcool) = 2,0 x 1,04 / 108,1 =0,0192 mol.
n(ion permanganate) = 0,120 x0,25 =0,03 mol.
2.4 Quelle espèce est introduite en défaut ? On justifiera brièvement la réponse.
0,0192 /3 =0,0064 mol ; 0,03 / 4 =0,0075, valeur supérieure à 0,0064 ( ion permanganate en excès, alcool en défaut).
Après refroidissement du mélange réactionnel, on filtre sur Büchner.
2.5 Quel est l’intérêt d’une filtration sur Büchner par rapport à une filtration simple ?
Filtration plus efficace et le solide récupéré est plus sec.
2.6 Quelle espèce solide est éliminée lors de cette étape ?
MnO2.
On ajoute au filtrat une solution d’acide chlorhydrique : il se forme
un dégagement gazeux de dioxyde de carbone et un solide précipite.
Après séchage, on obtient 2,04 g d’acide benzoïque.
2.7 Quelle est la formule chimique du dioxyde de carbone ?
CO2.
2.8 Par quel test pourrait-on vérifier que le gaz qui s’échappe est bien du dioxyde de carbone ?
Le dioxyde de carbone trouble l'eau de chaux.
2.9 Vérifier que la quantité d’ion benzoate que l’on devrait obtenir si la réaction était totale vaut nbenzoate= 0,019 mol.
n(benzoate) = n(alcool) = 0,019 mol.
2.10 La réaction de précipitation étant totale, quel est le rendement de cette synthèse ?
Donnée : masse molaire acide benzoïque : 122 g.mol-1.
Masse théorique d'acide benzoïque : 122 x0,019 = 2,32 g.
Rendement = masse réelle / masse théorique =2,04 / 2,32 =0,88 ( 88 %).
2.11 Plusieurs méthodes permettent d’identifier le produit final. Relier le matériel à la technique correspondante :
Réfractomètre : mesure de l’indice de réfraction.
Chromatographie : plaque CCM.
Spectrophotomètre : courbe d’absorbance.
Mesure de la température du point de fusion : banc Köfler.
3. Préparation du TP au laboratoire
Un enseignant souhaite faire cette synthèse avec des élèves (4 groupes
de 9 binômes). En préparant son TP, il demande les FDS de l’alcool
benzylique et du permanganate de potassium. On rappelle les quantités
indiquées dans le protocole des élèves : le ballon contient
initialement 2,0 mL d’alcool benzylique ; l’ampoule de coulée contient
un volume V=120 mL d’une solution de permanganate de potassium de
concentration molaire C=0,25 mol.L-1.
3.1 Que signifie le sigle FDS ?
Fiche de données de sécurité.
3.2 Citer 2 informations que l’on trouve dans une FDS.
Risques et dangers ainsi que les moyens de les réduire.
3.3 Dans la FDS, on trouve l’indication « Résumé de l’évaluation des propriétés CMR ». Que signifie le sigle CMR ?
Cancérogène, mutagène et reprotoxique.
3.4 La formule
topologique de l’alcool benzylique est donnée dans le cadre. Dessiner
sa formule développée. Entourer le groupement caractéristique et le
nommer.
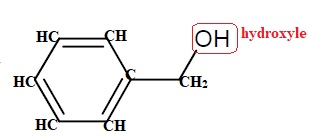
3.5 Quel volume de permanganate de potassium faudra-t-il prévoir pour que tous les binômes puissent réaliser cette synthèse ?
4 x9 x0,12=4,32 L ( arrondi à 5 L)
3.6 Pour préparer cette solution, quelle masse faut-il peser ?
Donnée : masse molaire du permanganate de potassium : 158,03 g.mol-1.
n = 5 x 0,25 =1,25 mol.
Masse : 1,25 x158,03 =197,5 g.
3.7 Le laboratoire
dispose de 3 balances dont on donne un extrait des caractéristiques. En
justifiant le choix, quelle balance doit-on utiliser ?
Portée maximale : 200 g ; précision 0,01 g.
|
|
|





