Physique
chimie, comparaison de deux procédés de production de dihydrogène.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
A. L’eau
: une source de dihydrogène.
A1. Approche historique.
Depuis l’Antiquité, l’eau est considérée comme un élément simple. Pour
convaincre la communauté des chimistes du contraire, Antoine-Laurent de
Lavoisier organise, du 27 février au 1er mars 1785, des expériences
devant une assemblée composée de chimistes de l’Académie et de
personnalités. Il est alors admis que l’eau se décompose en deux
substances, dont le dihydrogène.
Q1. Écrire
l’équation de décomposition de l’eau en corps purs simples.
H2O(l) --> H2(g) + ½O2(g).
À partir des résultats de l’expérience de décomposition de l’eau,
déterminer le pourcentage massique d’hydrogène contenu dans l’eau.
Commenter le résultat obtenu.
En pénétrant dans un canon de fusil chauffé au rouge, l'eau forme des
oxydes de fer. La masse du canon croît de 90,773 g. 13,172 g de
dihydrogène sont recueillis.
Masse totale d'oxygène ( sous forme d'oxyde de fer) et de dihydrogène
formés :
m = 90,773 + 13,172 =103,945 g.
L 'hydrogène représente donc : 13,172 / 103,945 ~0,1267 ( 12,67 %) de
cette masse.
Pourcentage réel d'élément hydrogène dans l'eau : 2 / 18 ~0,11 ( 11 %).
Ecart relatif : (12,67 -11) / 11 ~ 0,15 ( 15 %).
Les deux résultats sont cohérents en tenant compte de l'imprécision des
pesées faites par Lavoisier.
Le dihydrogène peut servir de combustible pour
alimenter les moteurs à hydrogène de véhicules dits « décarbonés ». La
production du dihydrogène peut se faire par électrolyse (5 % de la
production mondiale) ou par vaporeformage du méthane (41 % de la
production mondiale).
A2 Étude de l’électrolyse
de l’eau.
Q2. a)
compléter le document en proposant un schéma sur lequel sont indiqués :
les déplacements des porteurs de charges, l’anode, la cathode, la
polarité des électrodes, ainsi que les demi-équations électroniques se
produisant à
chacune des électrodes.
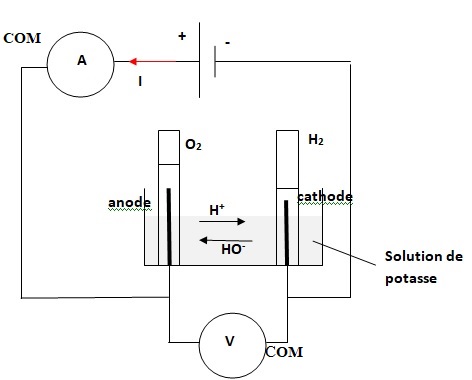
Oxydation de l'eau à
l'anode : 2 H2O(l) --> O2(g) +4H+aq
+4e-.
Réduction de l'eau à la cathode : 2H2O(l) +2e--->
H2(g) ++2HO-aq.
b) Donner l’expression littérale de
la puissance électrique fournie par le générateur, et en indiquant
l’unité de chaque
grandeur impliquée.
P = U I.
P : puissance en watt délivrée par le générateur.
U : tension ( V) aux bornes du générateur ; I(A) intensité du courant.
c) Rédiger deux
solutions partielles permettant de venir en aide à un élève ayant des
difficultés sur cette activité.
Réaliser un circuit en branchant en série, le générateur, l'ampèremètre
et l'électrolyseur.
Brancher le volmètre en dérivation aux bornes de l'électrolyseur.
Les gaz sont receuilis dans des tubes à essais retournés à l'envers sur
les électrodes par déplacement d'eau.
Relation entre puissane et énergie : Energie ( J) = Puissance (watt) x
temps (s).
Utiliser la loi des gaz parfaits pour déterminer la quantité de matière
puis la masse de dihydrogène.
Q3.
Expliciter les hypothèses qui sont réalisées afin de pouvoir modéliser
un gaz comme parfait.
Un
gaz réel se comporte comme un gaz parfait à pression très faible,
quelque soit la température, ou bien à basse pression et haute
température.
A l'échelle microscopique, un gaz parfait est un gaz dans lequel les
interactions entre molécules sont nulles, en dehors des chocs. la
taille des molécules est négligeable devant la distance
intermoléculaire moyenne.
Q4.
La production industrielle de dihydrogène est réalisée par électrolyse
d’une solution aqueuse d’hydroxyde de potassium (ou potasse). La valeur
classique de la tension utilisée est de U = 1,8 V. Le rendement
faradique η de la transformation vaut 70 %.
a)
Donner la loi de Faraday reliant la quantité de matière d’électrons à
la charge électrique circulant dans le circuit lors de l’électrolyse.
Q = n(e-) F = I t avec F = NA e.
b) Montrer que
l’énergie E consommée lors de l’électrolyse s’exprime selon la relation
suivante : E = 2Fm(H2) U / (M(H2)x h).
Quantité de matière de dihydrogène : n(H2) = 0,5 n(e-)
= 0,5 I t / F.
Energie consommée E = U I t = 2 U n(H2) F = 2 U F m(H2)
/ (M(H2)
Prendre en compte le rendement : E
= 2Fm(H2) U / (M(H2)x h).
. c) En déduire l’énergie consommée
par tonne de dihydrogène produite. Rendement de l'électrolyse : 0,70.
E = 2 *96500 *1,8 *1,0 106 /(2*0,7) ~2,5 1011 J.
Soit 2,5 1011 / (3,6 106) ~6,9 104 kWh.
|
...
|
....
|
A3. Étude du vaporeformage du méthane.
La réaction de vaporeformage se déroule à haute température (1030 K) et
haute pression (33 bar) dans un fourneau en présence de catalyseur.
Dans les conditions industrielles, la conversion du méthane peut être
considérée comme totale. La transformation est modélisée par la
réaction chimique d’équation :
CH4(g) + 2 H2O(g) → CO2(g) + 4 H2(g).
Le coût de production du dihydrogène par vaporeformage est estimé
à 2 euros par kilogramme de dihydrogène produit.
Q5. Définir la
notion «
d’énergie de liaison », puis calculer l’énergie molaire de la réaction
de vaporeformage du méthane. Préciser le caractère endothermique ou
exothermique de cette réaction.
L’énergie molaire de réaction peut être assimilée à l’enthalpie
standard de réactionr DrH°.
L'énergie de liaison est l'opposéé de l'énergie qu'il faut fournir pour
casser cette liaison.
DrH°=4DfH°(C-H) +4 DfH°(O-H) -[2DfH°(C=O)
+4DfH°(H-H).
DrH°=4*411,0
+4*458,8-[2*798,9+4*432,0]=1644+1835,2-1597,8-1728= 153,4 kJ / mol.
DrH°
étant négatif, la réaction est endothermique. Il faut fournir de
l'énergie pour que la réaction se produise.
. Q6. En déduire l’énergie consommée lors de la
production d’une tonne de dihydrogène par vaporeformage.
153,4 * 1,0 106 / 2 =7,67 107 kJ
~7,7 1010 J.
Soit : 7,7 1010 / (3,6 106)~2,1 104 kWh.
A4.
Comparaison des deux processus de production.
Un professeur d’une
classe de terminale STL spécialité SPCL, prépare
l’un de ses groupes d’élèves à la présentation orale de leur projet
portant sur « L’Hydrogène Énergie : une filière d’avenir ? ».
L’objectif du projet des élèves est de comparer les avantages et les
inconvénients des deux grands modes de production du dihydrogène : par
électrolyse ou par vaporeformage. Un extrait de leur conclusion est
présenté ci-dessous.
Extrait : « La
filière hydrogène est la solution pour le développement
durable si on développe l’électrolyse. On le fabrique à partir d’eau,
ce n’est pas beaucoup plus cher que le vaporeformage, et le bilan
carbone est neutre (le procédé ne fabrique pas de dioxyde de carbone)
».
Q7. Corriger la
conclusion proposée par
ces élèves. Indiquer quelques éléments à leur transmettre pour
l’améliorer afin de l’inscrire dans une dimension énergétique et
environnementale plus globale.
Prix moyen du kWh pour les
professionnels : 8 centimes d’euro ; masse moyenne de dioxyde de
carbone rejetée par kWh d’électricité produit : 74 g
|
Coût
( pour 1 tonne H2)
|
empreinte
carbone
|
Electrolyse
|
6,9
104 *0,08=5556 €
|
0,074
*6,9 104 ~5,1 103 kg =5,1 t
|
Vaporeformage
|
2,1
104 *0,08= 1680 €
|
n(CO2)
=0,25 n(H2)=0,25 *1,0 106 /2 =1,25 105
mol.
masse : 1,25 105 *0,044 =5,5 103 kg = 5,5 t.
A cela il faut ajouter : 0,074 *2,1 104 =1,56 103 kg = 1,6 t.
total : 7,1 t.
|
Erreur commise : le procédé
par électrolyse n'est pas neutre en dioxyde de carbone sauf si
l'électricité est produite à partir de l'énergie solaire en
utilisant des capteurs photovoltaïques.
|
|
