Hémisynthèse
et titrage de l'aspirine. Concours
CAPLP
2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Hémisynthèse de l'aspirine.
1. Justifier le choix de l'enseignant de ne proposer cette activité expérimentale qu'à certains élèves.
Une activité expérimentale s'adrees à un petit groupe d'élèves et est très motivante.
L'accompagnement personnalisé aide un petit groupe d'élèves à
progresser et à améliorer leurs compétences. Il peut également aider à
préciser un projet d'études après le baccalaurat.
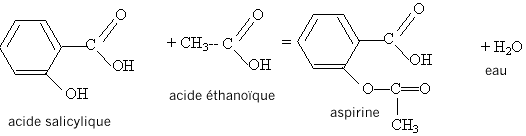
Equation de la synthèse de l'aspirine :
2. Nommer les différentes espèces.
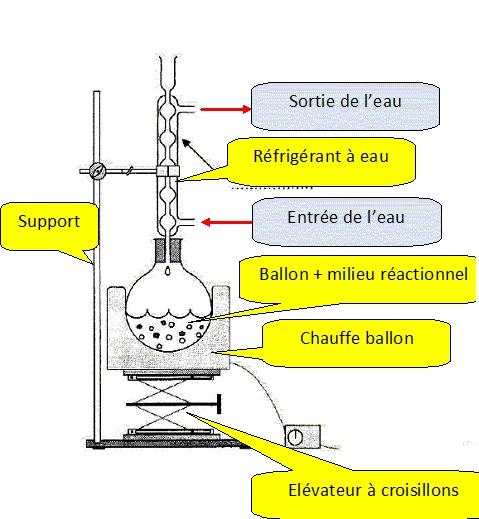
3. Légender le schéma du montage à reflux.
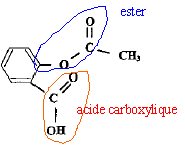
4. Entourer la fonction ester présente dans la molécule d'acide acéthylsalicylique.
 5. Pourquoi choisit-on d'utiliser l'anhydride éthanoïque plutôt que l'acide éthanoïque.
5. Pourquoi choisit-on d'utiliser l'anhydride éthanoïque plutôt que l'acide éthanoïque.
La réaction est totale avec l'anhydride éthanoïque ; elle est limitée avec l'acide éthanoïque.
6. Montrer que l'anhydride éthanoïque est en excès et justifier ce choix.
m = 5,0 g d'acide salicylique M =138,1 g / mol ; n = 5,0 / 138,1 ~0,036 mol.
10,0 mL d'anhydride éthanoïque ; d = 1,082 ; M =102,1 g / mol ; n = 10,0 x 1,082 / 102,1~0,106 mol.
0,036 mol d'acide salicylique réagit avec 0,036 mol d'anhydride éthanoïque. Or on en a 0,106 mol ; celle-ci est donc en excès.
On est certain que tout l'acide salicylique aura réagi.
7. Déterminer la masse maximale d'aspirine que l'on peut obtenir.
M aspirine = 180,2 g / mol ; n = 0,036 mol ; m = 0,036 x 180,2 =6,5 g.
8. Donner en les justifiant les règles de sécurité devant être respectées.
Port de blouse, gants et lunettes de protection ; travailler sous hotte
( vapeurs irritantes pour les voies respiratoires et les yeux) loin de
toute flamme ( liquide inflammable).
9. Ecrire l'équation de la réaction d'hydrolyse de l'excès d'anhydride éthanoïque.
(CH3-CO)2 O + H2O --> 2 CH3-COOH.
10. Identifier les espèces chimiques contenues dans le mélange à la fin de l'opération de cristallisation.
Eau, acide éthanoïque et acide sulfurique.
11. En plus de l'eau, quelle est la principale impureté éliminée par filtration ?
L'acide éthanoïque.
12. On obtient 4,96 g d'aspirine. En déduire le rendement.
Masse réelle / masse théorique = 4,96 / 6,5 ~0,76 ( 76 %).
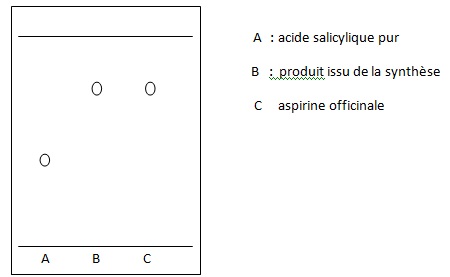
13. Représenter en le justifiant l'allure du chromatogramme que les élèves pourraient réaliser.
14. Expliquer
comment l'enseignant pourrait évaluer la compétence " Valider". (
contrôler la vraissemblance d'une hypothèse, argumenter, critiquer un
résultat).
Suivre correctement chaque étape du protocole, isoler l'aspirine et
d'identifier le produit obtenu permet d'être évaluer sur la compétence
"Valider".
|
...
|
....
|
Titrage pHmétrique de l'aspirine.
On dissout 4 comprimés d'aspirine 500 mg dans 1,00 L d'eau distilée. On
réalise le titrage acido-basique d'un volume V = 50,0 mL de la solution
par une solution d'hydroxyde de sodium de concentration C = 5,00 10-2 mol / L.
15. Montrer
que l'action d'une solution d'hydroxyde de sodium sur l'acide
acéthylsalicylique peut se modéliser par deux réactions chimiques
concurrentes. Ecrire leurs équations.
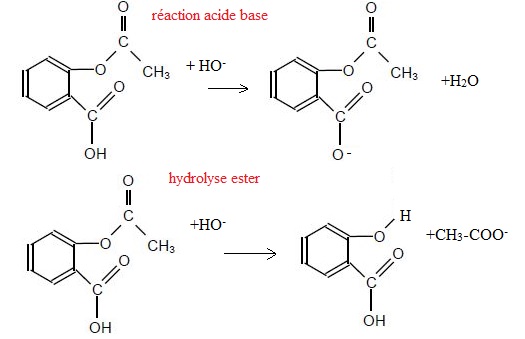
16. Comment empécher que la réaction d'hydrolyse ait lieu.
A froid avec une solution de soude diluée, seul le groupe carboxyle réagit selon une réaction acido-basique.
A chaud avec une solution de soude concentrée, le groupe ester subit une hydrolyse.
17. Les résultats du titrage permettent-il de montrer que seule la réaction souhaitée s'est effectivement produite ? Justifier.
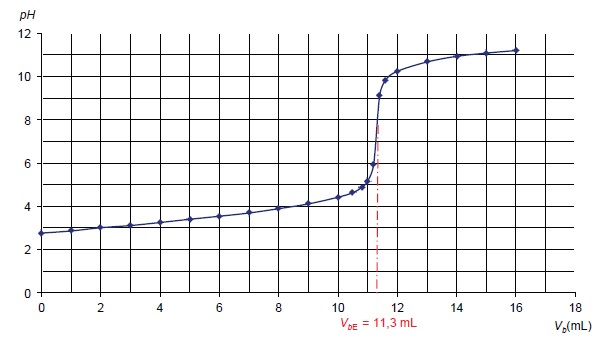
Le titrage présente un seul saut de pH, seule la réaction acide base se produit.
18. Pour l'acide acéthylsalicylique et pour les deux indicateurs colorés, exprimer la valeur du rapport [A- ] / ([AH] + [A- ]) pour un pH de 6.
Aspirine / ion acéthylsalicylate : pKa = 3,5 ;
bleu de bromothymol : Hin1 / In1- : pKa = 7,0 ; hélianthine : Hin2 / In2- : pKa = 3,7.
36.
Proposer une expérience permettant de modéliser le principe de
l'échographie.
Ka = [A- ] [H+] / ([AH] ; [AH] / [A- ] = [H+] / Ka ; 1+ [AH] / [A- ] = 1+[H+] / Ka ;
([AH] + [A- ]) / / [A- ] = (Ka +[H+] )/ Ka ; [A- ] / ([AH] + [A- ]) = Ka / (Ka +[H+] )
Aspirine / ion acéthylsalicylate : 10-3,5 / (10-3,5 + 10-6)=0,997.
Hélianthine :10-3,7 / (10-3,7 + 10-6)=0,995.
Bleu de bromothymol : 10-7 / (10-7 + 10-6)=0,091.
On considère qu'un indicateur coloré convient pour un titrage à 1% près
lorsque 99 % de l'acide à titrer a réagi, alors que seulement 10 %
environ de la forme acide de l'indicateur coloré ( début de la
zone de virage) a réagi avec le réactif limitant.
19. Quel indicateur coloré convient ? Justifier.
D'après le calcul précédent : 99 % de l'acide à réagi.
9 % de la forme acide du bromothymol a également réagi. Ce dernier convient.
99 % de la forme acide de l'hélianthine a réagi : cet indicateur ne convient pas.
Règle plus simple
: le pH du point équivalent ( 7 dans ce cas) doit appartenir à la zone
de virage de l'indicateur coloré ( [6 ; 8 ]pour le bromothymol et
[2, 7 ; 4,7] pour l'hélianthine.
A l'équivalence : quantité de matière d'aspirine : 5,00 10-2 x11,3 =0,565 mmol dans 50 mL soit 0,565 x20 = 11,3 mmol dans 1 L ( 4 comprimés).
Masse daspirine : 11,3 xM(aspirine) = 11,3 x180 =2,03 103 mg dans 4 comprimés.
Soit environ 500 mg d'aspirine par comprimé.
|
|