Chimie,
concours technicien ministère de l'économie et des finances
2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Chimie.
1. pH-métrie.
On souhaite préparer une solution A
d'acide sulfurique de concentration Ca = 10-2 mol/L à
partir d'une solution commerciale 97 %, d = 1,84 ; M = 98,08 g/mol.
1. Calculer le
volume de solution commerciale à prélever pour préparer 200 mL de
solution A.
Dans 1 L de solution commerciale : masse d'acide1,84 x0,97 =1,7848 kg.
C= 1,7848 103 / 98,08 ~18,2 mol /L.
Facteur de dilution : F = 18,2 / 10-2 =1820.
Volume de solution commerciale à prélever : 200 / 1820 =0,11 mL.
On souhaite préparer une solution B d'hydroxyde de potassium de
concentration Cb = 0,25 mol / L à partir de pastilles d'hydroxyde de
potassium.
2. Calculer la
masse de KOH à peser pour préparer 200 mL de solution B.
M(KOH) = 56 g / mol ; n = 0,200 x 0,25 = 0,05 mol ; masse à peser :
0,05 x56 =2,8 g.
3. Quel volume Va
de solution A doit-on ajouter pour neutraliser Vb = 20 mL de solution B
?
H2SO4 aq + 2KOHaq --> K2SO4aq
+ 2H2O(l).
n(KOH) = 20 x0,25 =5 mmol ; n(H2SO4) =2,5 mmol ; Va =2,5 10-3 /
0,01 =0,25 L.
4. Après
l'équivalence, on continue d'ajouter de l'acide : quel volume V'a
doit-on à nouveau verser pour obtenir un pH final égal à 2 ?
A l'équivalence, pH = 7 ; [H3O+]éq
= 10-7 mol / L.
[H3O+]fin
= 0,01 mol / L ; Vfin = Vb+Va+V'a
=0,020 +0,250 +V'a = 0,27 +V'a
en L.
n(H3O+)ajouté =0,01(0,27 +V'a).
[H3O+]initial =
0,02 mol / L ; n(H3O+)ajouté =0,02 V'a.
0,02 V'a = 0,01(0,27 +V'a) ; V'a =0,27 L.
5. Quels sont les équipements de
protection individuels et collectifs indispensables à mettre en oeuvre
dans le cadre de cette manipulation ?
Port de blouse, gants et lunette de protection. Travail sous hotte.
6. A quoi sert une
Fiche de Données de Sécurité ( FDS) dans le cas présent ?
Elles donnent les risques et dangers concernant une substance et les
moyens de les réduire.
Elles contiennent les consignes en cas d'ingestion accidentelle et les
données toxicologiques.
2. Contrôle qualité de médicament.
1. Synthèse du paracétamol.
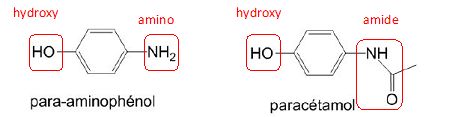
7. Entourer les groupes
caractéristiques et préciser les familles de composés du
para-aminophénol et du paracétamol.
Le
para-aminophénol appartient à la famille des phénols ainsi qu'à celle
des amines aromatiques.
Le
paracétamol appartient à la famille des amides ainsi qu'à celle des
phénols.
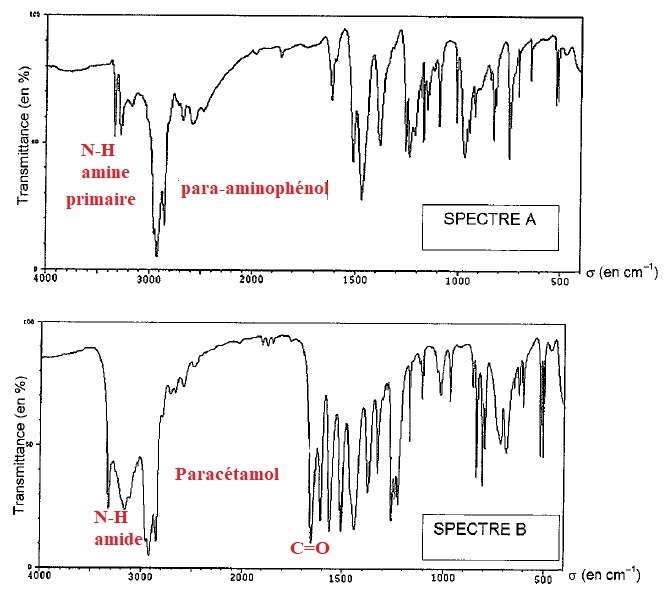
On donne le spectre
infrarouge du para-aminophénol et celui du produit synthétisé.
8. Donner le
principe de fonctionnement d'un spectrophotomètre infrarouge.
La spectrométrie infrarouge s’utilise
principalement pour l’analyse qualitative d’une molécule. Elle permet
de mettre en évidence la présence d’une liaison particulière. Dans une
molécule, les liaisons chimiques peuvent être décrites comme des
ressorts liant les atomes.Lorsqu’une molécule absorbe de l’énergie sous
la forme d’un rayonnement infrarouge, les atomes se mettent à vibrer.
Ils entrent alors en oscillation.
La Spectroscopie
Infrarouge à Transformée de Fourier (FTIR) est basée sur l'absorption
d'un rayonnement infrarouge par le matériau analysé. Elle permet via la
détection des vibrations caractéristiques des liaisons chimiques entre
deux atomes d'effectuer l'analyse des fonctions chimiques.
La spectrométrie IRTF est
basée sur l'obtention dans le domaine temporel d'un interférogramme à
l'aide d'un interféromètre de Michelson. Le spectre désiré est ensuite
obtenu par transformée de Fourier de cet interférogramme.
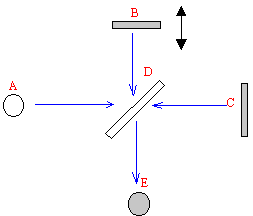
L'interféromètre de
Michelson est constitué de deux miroirs B et C, d'une lame séparatrice
semi-transparente D;
A est la source lumineuse
et E le plan d'observation ( détecteur)
L'échantillon doit être
placé entre l'un des miroirs et la lame D.
9.
Rappeler la loi de Beer-Lambert.
A= log (I0/I)
= elc ( A est l'absorbance ou densité
optique)
où e est un coefficient caractéristique de la
substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
Les concentrations doivent être inférieures à 0,01 mol / L.
10. A quoi sont dues les bandes
d'absorption à 3341 et 3248 cm-1 ?
11. l'analyse du spectre du produit synthétisé permet-elle de valider
la formation du paracétamol ? Oui.
2. Dosage du paracétamol.
On veut vérifier la teneur en paracétamol contenu dans un
comprimé " paracétmol 500 mg".
On souhaite réaliser un dosage par étalonnage. On prépare une solution
par dissolution d'un comprimé dans une fiole jaugée de 1 L.
On réalise le spectre UV visible d'une solution de paracétamol de
concentration 0,02 mol / L.
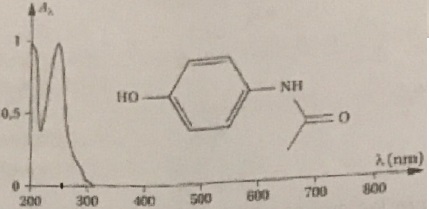
12. A
quelle longueur d'onde doit-on travailler ?
Pour un maximum de précision, on se place au maximum d'absorption, vers
250 nm.
13. Expliquer le
principe d'un dosage par étalonnage.
On
réalise une gamme étalons de concentrations connues à partir d'une
solution mère. On mesure l'absorbance de ces solutions.
On trace la courbe A = f(concentration).
Les concentrations des solutions étalons doivent contenir la
concentration de la solution inconnue.
On mesure l'absorbance, dans les mêmes conditions, de la solution de
concentration inconnue.
3. Titrage de l'ibuprofène d'un médicament.
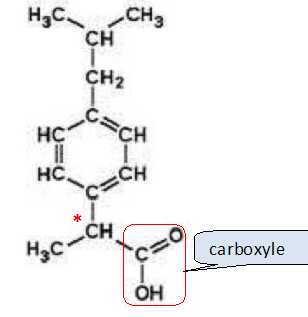
14. Donner la
formule brute de l'ibuprofène.
C13H18O2.
Afin
de réaliser le titrage de l'ibuprofène contenu dans un comprimé
d'ibuprofène 400 mg, on broie le comprimé dans 20 mL d'éthanol. On
filtre le mélange obtenu. Le filtrat contenant l'ibuprofène est placé
dans un becher auquel on ajoute 40 mL d'eau distillée.
On titre le contenu du becher à l'aide d'une burette graduée contenant
une solution aqueuse d'hydroxyde de sosium de concentration Cb = (2,0
±0,1) 10-1 mol / L. Le titrage est suivi par pHmétrie.
15. Définir l'équivalence d'un
titrage.
A l'équivalence, les quantité de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
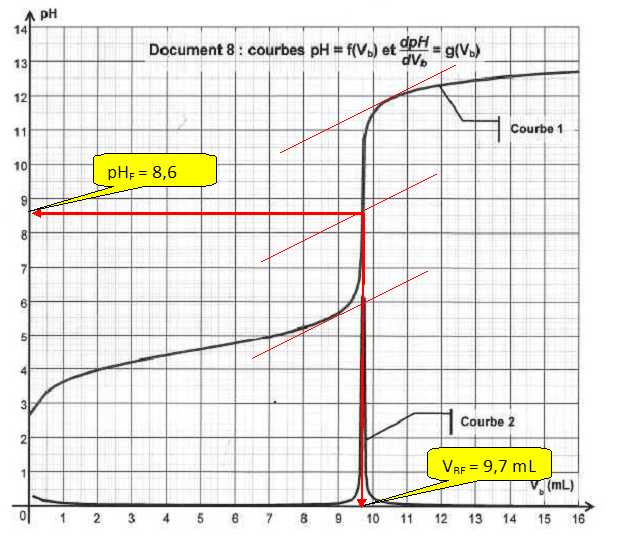
16. Déterminer le
volume équivalent.
17. A quel couple acide base
appartient l'ion hydroxyle ?
H2O / HO-aq.
18. Ecrire
l'équation de la réaction support du titrage.
RCOOH aq +HO-aq
--> RCOO-aq + H2O(l).
19. Quelles
caractéristiques doit posséder une réaction chimique pour être
utilisée lors d'un titrage ?
Totale et rapide.
20. Déterminer la
masse d'ibuprofène contenu dans un cachet et conclure.
A l'équivalence ; CaVa = CbVE ; CaVa
=
9,7 x 0,20 =1,94 mmol.
M(ibuprofène) =206 g / mol.
Masse d'ibuprofène dans un comprimé : 1,94 x 206 ~ 400 mg.
On
souhaite évaleur l'incertitude U(m) sur la masse m liée aux différentes
sources d'erreurs avec un niveau de confiance de 95 %. Dans ces
conditions :
- l'incertitude sur la mesure du volume versé par cette burette est Uvol
=0,16 mL ;
- l'incertitude sur la concentration en hydroxyde de sodium est Ucb
=0,010 mol/L.
L'incertitude U(m) sur la masse est alors telle que : U(m)/m = [(Uvol/VBE)2
+(Ucb/cb)2 ]½.
U(m)
= [(0,16 / 9,7)2 +(0,010 / 0,20)2 ]½=
5,3 10-2 g.
m =( 0,40 ± 5 10-2 ) g. En accord avec l'indication " 400
mg".
|
...
|
....
|
3. Techniques séparatives.
Répondre par vrai ou faux.
21. Le débit de la
phase mobile intervient sur l'efficacité d'une séparation. Vrai.
Plus la vitesse de la
phase mobile diminue, plus les molécules de soluté peuvent pénétrer
dans la phase stationnaire ; l'équilibre entre les deux phases est
favorisé et plus la colonne est performante.
22. En
chromatographie liquide haute performance, sur une colonne non polaire,
le temps de rétention d'un acide organique augmente si le pH de la
phase mobile augmente suffisament. Faux.
A pH élevé, l'acide est
sous forme RCOO- polaire.
23.
En chromatographie en phase gazeuse, la température n'a pas d'effet sur
les facteurs de rétention. Faux.
24. Lorsqu'on fait
un gradient d'élution avec une colonne RP-18, on diminue généralement
la polarité de la phase mobile au cours du temps. Vrai.
25. Un facteur
se sélectivité proche de 1 implique une mauvaise résolution. Vrai.
26. En CCM sur phase normale, un
composé non polaire est entraîné par la phase mobile. Vrai.
La phase stationnaire est
plus polaire que la phase mobile.
27. En chromatographie en phase
gazeuse, on injecte 1 µL d'une solution à 1 % en volume d'un composé A.
Le rapport de split est réglé à 100 : 1. La densité de la solution est
de 0,9 g /L. La masse de A migrant dans la colonne est de 90 µg. Faux.
0,9 µg / µL ; partie
injectée dans la colonne / partie injectée vers l'extérieur :
100 : 1.
28. Dans une
séparation, tous les composés passent le même temps dans la phase
mobile. Faux.
Chimie organique -
stéréochimie.
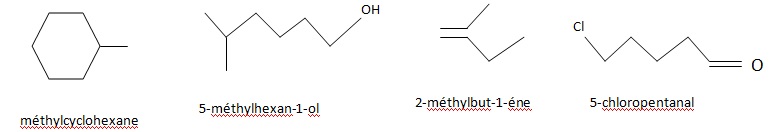
29. Dessiner la formule semi-développée ( en ecriture topologique) des composés suivants :
30. Combien d'atomes de carbone asymétriques possède la molécule d'erythronolide B ?
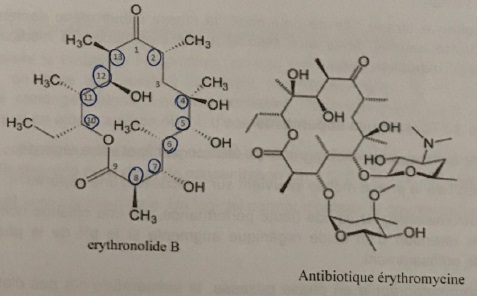
10 atomes de carbone asymétriques.
31. En déduire le nombre de stéréoisomères possibles.
210.
On donne la séquence réactionnelle de préparation du linalol.
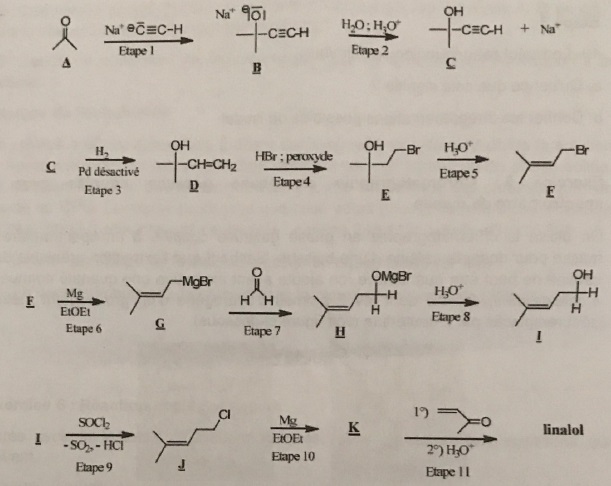
32. Etape 1, nommer la fonction portée par le composé A.
Cétone.
33. Etape 2, le composé C présente une bande IR moyenne large entre 3200 et 3500 cm-1. Identifier la fonction responsable.
Fonction alcool lié par liaison hydrogène.
34. A quelle grande catégorie de réaction appartiennent l'ensemble des étapes 1 +2 ?
Additions sur une double liaison.
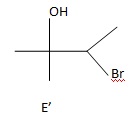
36. Peut-on envisager la formation d'un autre produit que E noté E' ? Représenter E'.
37. Peut-on envisager une isomérie Z,E pour le composé F ?
Non, l'un des atomes de carbone doublement lié porte les même substituants CH3.
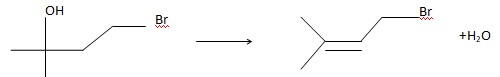
38. H3O+ est le catalyseur de la réaction ( étape 5). Ecrire l'équation bilan de la réaction.
39. A quelle grande catégorie de réaction appartient l'étape 5 ?
Elimination.
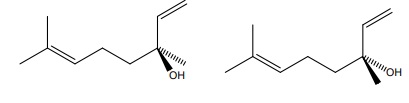
40. Le linalol est une molécule chirale. Qu'est ce que cela signifie ? Donner deux représentations possibles du linalol.
Une molécule chirale n'est pas supperposable à son image dans un miroir plan.
5. Chromatographie en phase gazeuse couplée à un spectrographe de masse.
Dosage de la cafeine d'une boisson. On ajoute avant extraction une
quantité connue de "caféine-d3", caféine dont les 3 atomes d'hydrogène
d'un groupe méthyle sont remplacés par le deutérium.
Deux solutions mères sont préparées :
A : on dissout 51,1 mg de caféine dans 50 mL de méthanol.
B : on dissout 27,8 mg de caféine -d3 dans 25 mL de méthanol.
Solution de standardisation S : on prépare 200 µL de cette solution en mélangeant 100 µL de A et 100 µL de B.
On injecte 1 µL de cette solution dans le chromatographe et on repère
le pic d'élution de la caféine ( les deux caféine marquée et non
marquée ont le même temps de rétention ). On compare les aires des deux
pseudochromatogrammes obtenus l'un à partir de l'intensité du pic
moléculaire de la caféine et l'autre à partir de celui de la
caféine-d3. On obtient respectivement 420 625 et 366 100 ( unités
arbitraires).
41. Quelles sont les masses nominales de la caféine et de la caféine-d3 ?
C8H10N4O2. Masse nominale : 8 x12 +10 +4x14 +2 x16 =194.
C8H7D3N4O2. Masse nominale : 8 x12 +7+3 x2 +4x14 +2 x16 =197.
42.
Calculer les concentrations en caféine et caféine-d3 des
solutions A et B en g / L puis la concentration de S en µg / µL.
A : 51,1 / 50 =1,022 g / L ; B : 27,8 / 25 =1,112 g / L.
Masse de 100 µL de A : 1,022 10-4 g ; masse de 100 µL de B : 1,112 10-4 g.
Masse de 200 µL de S : 2,134 10-4 g = 213,4 µg ; 213,4 / 200 = 1,067 µg / µL.
43. Calculer le coefficient de réponse relatif kd3/caf de la caféine d3 par rapport à la caféine.
Un coefficient de réponse relatif correspond à un rapport d'aire
d'un composé par rapport à un autre en fonction de leur concentration
ou de leur masse respective.
kd3/caf =420 625 / 366 100 ~1,149.
Analyse de l'échantillon.
On prélève 1 mL de Coca-Cola à doser dans laquelle on ajoute 50 µL de
la solution B. Après mélange, on extrait les deux caféines sur une
cartouche en phase solide. On récupère dans un peu de méthanol une
partie du mélange des caféines que l'on injecte en CPG. Le même
processus que celui décrit pour le calcul du coefficient de réponse
conduit aux intensités suivantes : caféine 248 112, caféine-d3 112 360.
44. Donner le principe de la micro-extraction en phase solide ( SPME).
Elle permet de réaliser une extraction et une concentration de composés se trouvant à l'état de traces.
Microextraction sur phase solide en mode espace de tête.
La
fibre en silice ( sur laquelle est greffé une phase stationnaire )est
plongée dans la solution à analysée ou dans l'espace de tête au dessus
de la solution. les analytes seront progressivement adsorbés par la
fibre.
Un
équilibre s'établit entre la phase solide ( fibre) et la phase gazeuse
ou liquide. On retire ensuite la fibre de l'échantillon.
La fibre peut être désorbée en chromatographie en phase gazeuse
45. En déduire la quantité de caféine dans la canette (330 mL).
kd3/caf =245 112 / 112 360 ~2,181.
Dans 50 µL de B, il y a 1,112 x 50 10-6 =5,56 10-5 µg de caféine-d3.
Dans 1 mL de boisson, il y a 5,56 10-5 x 2,181 =1,21 10-4 µg de caféine.
1,21 10-4 x330 =4,0 10-2 g= 40 mg de caféine.
|
|











