Les
canalisations en plomb, électroétamage.
Concours interne TSPEI 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
...
|
|
......
.....
|
Les
canalisations en plomb.
Atomistique.
1. Donner la composition de l'atome de plomb 20782Pb.
82 électrons, 82 protons et 207-82 =125 neutrons.
2. Même question pour l'ion 20782Pb2+.
80 électrons, 82 protons et 207-82 =125 neutrons.
Teneur en plomb d'une eau.
Les ions Pb2+ issus de la corrosion d'une paroi en plomb peuvent réagir avec les ions carbonates CO32- pour former du carbonate de plomb solide dont la solubilité dépend du pH de l'eau qui circule dans la canalisation.
2.1 Donner le diagramme de prédominance, en fonction du pH, des différentes espèces acido-basiques dérivées du dioxyde de carbone.
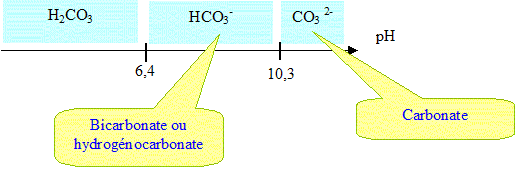
2.2 Ecrire l'équation de la réaction prépondérante de dissolution du carbonate de plomb dans une eau à pH = 7,5.
PbCO3(s) +H2O= Pb2+aq + HCO3--aq+ HO-aq.
2.3 Exprimer la constante d'équilibre de cette réaction en fonction du produit de solubilité Ks de carbonate de plomb, Ka2 et Ke. Calculer sa valeur.
Ks = [Pb2+][CO32-].
Ka2 = [H3O+] [CO32-] / [HCO3- ].
Ke = [H3O+] [HO - ].
K = [HCO3- ] [HO- ] [Pb2+] = [H3O+] [HO- ] [CO32-] Ks / (Ka2 [CO32-]) = Ke Ks / Ka2 .
K = 10-14 x 8,0 10-15 / (5,0 10-11) =1,6 10-18.
2.4 calculer la
concentration en ion hydroxyde. Donner la définition de la solubilité
puis calculer la valeur de la solubilité s du carbonate de plomb à ce
pH.
[HO - ] = 10-14 / 10-7,5 = 10-6,5 =3,16 10-7 mol / L.
A une température donnée, la solubilité est la quantité maximale de solide que l'on peut dissoudre dans 1 L d'eau.
s = [HCO3-aq] =[Pb2+aq] = { K / [HO-aq] }½ =[1,6 10-18 / (3,16 10-7)]½ =2,2 10-6 mol/L.
2.5. Calculer la teneur en plomb TPb (en μg.L-1) et conclure sur la problématique étudiée, en se référant aux normes relatives à l’eau potable.
TPb = s M(Pb) =2,2 10-6 *207,2 ~4,7 10-4 g/L =4,7 102 µg /L.
Cette valeur étant supérieure à 10 µg/L, cette eau ne peut pas être utilisée pour la consommation humaine.
|
...
|
|
|
....
|
Electroétamage.
On
désire étamer une boîte rectangulaire sans couvercle dont les
dimensions sont : L = 20 cm, largeur = 10 cm, hauteur h = 5,0 cm. On
veut déposer une couche d'étain d'épaisseur e = 50 µm. L'électrolyte
est une solution d'ion Sn2+aq. L'anode est en étain, la cathode est la boîte. Le générateur débite un courant d'intensité I = 3,0 A.
1. Faire le schéma du circuit en indiquant le sens du courant, l'anode et la cathode.
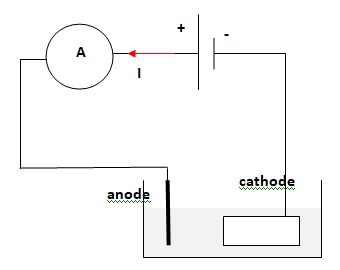
2. Ecrire
les demi-équations électroniques qui modélisent les
transformations ayant lieu aux interfaces métal-solution des électrodes
en précisant les électrodes concernées.
Réduction des ions Sn2+ à la cathode : Sn2+ aq+ 2e- ---> Sn(s).
Oxydation de l'étain à l'anode : Sn(s) --> Sn2+ aq + 2e- .
3. Déterminer la surface S à étamer et la masse d'étain déposée sur la
boîte (masse volumique étain = 7,3 g / cm3 ; M étain = 118,7 g / mol).
Fond : 10 x 20 = 200 cm2.
Côtés : 2 x(10 +20) x5 =300 cm2.
S = 500 cm2.
On suppose que l'on étame seulement l'intérieur de la boîte. ( si on
étame aussi l'extérieur, multiplier par 2 les résultats suivants )
Volume d'étain : S e = 500 x 50 10-4=2,5 cm3.
Masse d'étain : m = 2,5 x7,3 =18,25 ~ 18 g.
4. Calculer la charge Q nécessaire puis la durée de cette électrolyse.
n(étain) = m / M (étain) = 18,25 / 118,7 =0,1537 mol.
n(électrons) = 2 x0,1537 = 0,3075 mol.
Q = 96500 x0,3075 =2,97 104 C.
Durée : Q / I = 2,97 104 / 3,0 ~9,9 103 s.
5. Calculer la perte de masse de l'anode.
Cette perte de masse est égale à la masse d'étain déposé sur la boîte : 18 g.
6. Comment varie la concentration en ion étain de l'électrolyte ?
Dans cette électrolyse dite " à anode soluble", la concentration en ion étain de l'électrolyte ne varie pas.
|
|

