Chimie,
concours Puissance alpha 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Exercice 1. Etude d'une solution d'acide nitreux.
On dispose d'une solution d'acide nitreux HNO2 de concentration c=1,0 10-2 mol / L. Le pH de cette solution est égal à 2,7.
HNO2 aq / base conjuguée : pKa = 3,3 à 25°C.
a. L'acide nitreux est un acide totalement dissocié dans l'eau. Faux.
pH > -log(c) ; 2,7 > - log(1,0 10-2).
b. La base conjuguée de l'acide nitreux est l'ion nitrate NO3-aq. Faux ( NO2-aq).
On ajoute à la solution d'acide nitreux une solution basique d'éthanoate de sodium ( Na+aq +CH3COO-aq) de telle sorte que le pH du mélange obtenu, après réaction acido-basique, soit égal à 5,0.
c. Dans ce mélange, la concentration en acide nitreux est plus de 10 fois supérieure à celle de sa base conjuguée. Faux.
A pH =5, supérieure au pKa du couple ( HNO2aq / NO2-aq), l'ion nitrite prédomine..
d. La concentration en ion hydroxyde dans le mélange obtenu est égale à 1,0 10-9 mol / L. Vrai.
[H3O+aq] = 10-5 mol / L ; [HO-aq] = 10-14 / [H3O+aq] =1,0 10-9 mol / L.
Exercice 2. L'eau de Javel.
Les propriétés de l'eau de Javel sont dues à l'ion hypochlorite ClO-.
L'eau de Javel est commercialisée en berlingots de 200 mL,
concentration en ion hypochlorite = 2,0 mol /L, ou en
bidon, concentration en ion hypochlorite = 0,50 mol /L. Dans une eau de Javel, les ions hypochlorite réagissent lentement selon : ClO-aq ---> Cl-aq +½O2(g).
On réalise l'étude cinétique de cette réaction en titrant les ions hypochlorite présents dans un berlingot de volume V = 200 mL.
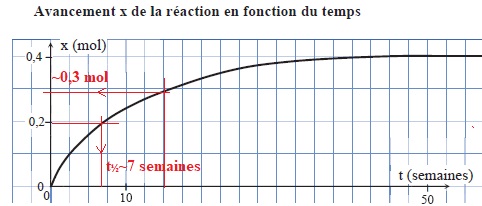
a. Le temps de demi-réaction est d'environ 20 semaines. Faux.
b. Au bout de 15 semaines, la concentration en ion hypochlorite est d'environ 0,5 mol / L. Vrai.
Il reste 0,4 -0,3 = 0,1 mol d'ion hypochlorite ; 0,1 / 0,2 = 0,5 mol / L.
c. A une température de 25°C la valeur du temps de demi-réaction serait plus élevée que la valeur à 20°C. Faux.
La température est un facteur cinétique.
Une personne vide le berlingot dans un litre d'eau.
d. La concentration en ion hypochlorite de cette eau de Javel diluée est de 0,4 mol / L. Vrai.
Facteur de dilution 1000 / 200 = 5 ; concentration de la solution diluée 2,0 / 5 = 0,4 mol / L.
Exercice 3. Etude d'une solution d'éosine.
Détermination de la concentration d'une solution d'éosine par spectrophotométrie.
On réalise le spectre d'une solution d'éosine notée S' de concentration c' = 1,0 10-5 mol / L.
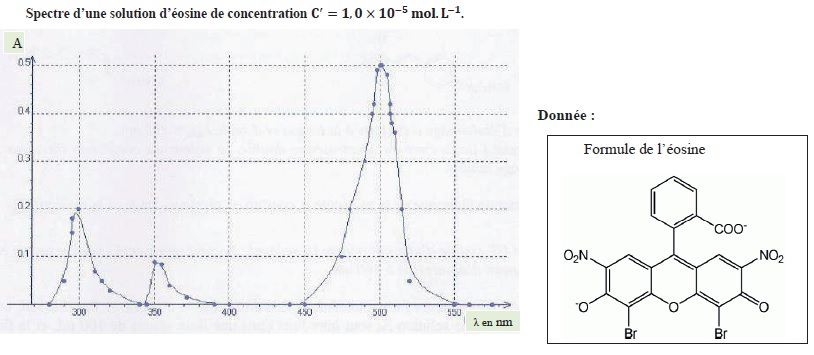
a. Il
s'agit d'un spectre d'absorption UV-visible. Vrai.
b. L'éosine est une espèce chimique de couleur cyan. Faux.
Le maximum d'absorption est vers 500 nm ( cyan). La solution possède la couleur complémentaire du cyan, soit le rouge.
On
mesure dans les mêmes conditions que précédemment, l'absorbance de la
solution d'éosine S de concentration inconnue. Il prépare un volume VS1 = 200,0 mL d'une solution S1 en diluant 10 fois la solution S. L'absorbance mesurée, pour une longueur d'onde de 500 nm, est A1 = 1,5.
c. Pour préparer S1 il faut prélever 10,0 mL de solution S. Faux.
200,0 / 10 = 20,0 mL.
d. La concentration de la solution S est c = 3,0 10-4 mol / L. Vrai.
Absorbance et concentration sont proportionnelles.
A = k c ; 0,5 = k x1,0 10-5 ; k = 5 104.
cS1 = 1,5 / (5,0 104) =3,0 10-5 mol / L.
Tenir compte de la dilution : c = 10 cS1 = 3,0 10-4 mol / L.
Exercice 4. Spectroscopie.
On souhaite identifier la molécule X ayant un seul groupe caractéristique de formule brute C4H8O. On a le choix entre trois molécules A, B et C représentées ci-dessous.
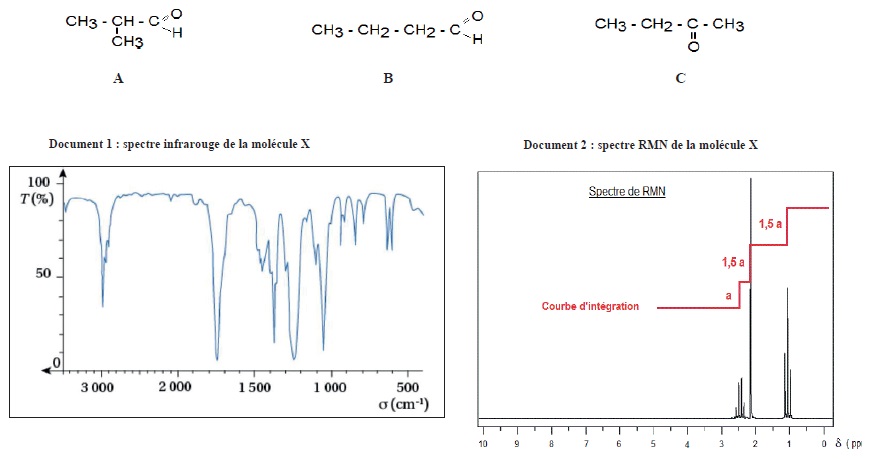
a. Le spectre IR ne permet pas d'identifier la molécule X. Vrai.
Les trois molécules possèdent un groupe carbonyle C=O, pic vers1700 cm-1.
b. Lamolécule X possède 8 groupes de protons équivalents. Faux.
3 goupes de protons équivalent : un singulet intégrant pour 3 ( CH3).
Un triplet intégrant pout 3 ; un quadruplet intégrant pour 2. ( H3C-CH2-)
c. Le signal situé à 2,4 ppm est un quadruplet. Vrai.
d. La molécule X est la butanone. Vrai.
Exercice 5. Etude d'un anti-diarrhétique.
On dissout un sachet de 7,00 g d'Adiaril dans l'eau pour obtenir 200 mL de solution.
Composition d'un sachet : 2,65 g de glucose ; 2,49 g de saccharose ; 0,210 g de chlorure.
Afin de vérifier la masse d'ion chlorure présent dans un sachet, on
dissout le contenu d'un sachet dans une fiole jaugée de 200 mL.
On réalise le titrage conductimétrique de V1 = 20,0 mL de cette solution à l'aide d'une solution titrante de nitrate d'argent de concentration c = 4,25 10-2 mol / L. le graphe ci-dessous précise l'évolution de la conductivité du mélange au cours du titrage.
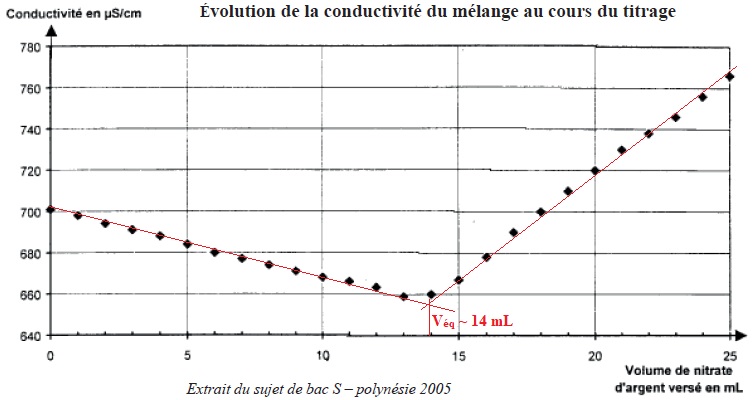 a.
La mesure de la conductivité dépend du type d'ions présents en solution mais pas de leur concentration. Faux.
b. Si la solution de nitrate d'argent était deux fois plus concentrée, le volume équivalent aurait été de 28 mL. Faux.
14 / 2 =7 mL.
c. La quantité d'ion chlorure présent dans le sachet est n = 0,595 mmol. Faux.
Ag+ aq + Cl-aq --> AgCl (s).
A l'équivalence n(Ag+ aq) = n(Cl-aq) =c Véq =4,25 10-2 x 14 = 0,595 mmol dans 20 mL de solution.
a.
La mesure de la conductivité dépend du type d'ions présents en solution mais pas de leur concentration. Faux.
b. Si la solution de nitrate d'argent était deux fois plus concentrée, le volume équivalent aurait été de 28 mL. Faux.
14 / 2 =7 mL.
c. La quantité d'ion chlorure présent dans le sachet est n = 0,595 mmol. Faux.
Ag+ aq + Cl-aq --> AgCl (s).
A l'équivalence n(Ag+ aq) = n(Cl-aq) =c Véq =4,25 10-2 x 14 = 0,595 mmol dans 20 mL de solution.
0,595 x200 / 20 = 5,95 mmol.
d. La masse expérimentale d'ion chlorure est m = 0,211 g.
L'écart relatif est donc d'environ 5 %. Faux.
(0,211-0,210) / 0,21 x 100 ~0,5 %..
|
|
|
....
|
Exercice 6. Traitement des rosiers.
Un jardinier possède une solution anti-chlorose riche en ion Fe2+aq. Il décide de doser ces ions.
Protocole :
Diluer 20 fois une solution anti-chlorose S. La solution diluée est notée S'.
Introduire dans un erlenmeyer V1 = 10,0 mL de solution S' et de l'acide sulfurique.
Réaliser le titrage à l'aide d'une solution de permanganate de potassium de concentration C2 = 5,0 10-3 mol / L. Véq = 8,0 mL.
MnO4-aq + 5Fe2+aq + 8 H+aq ---> Mn2+aq + 5Fe3+aq + 4H2O(l).
Seul l'ion permanganate est coloré ( teinte violette).
a. La disparition de la couleur violette indique la fin du titrage. Faux.
Avant
l'équivalence, l'ion permanganate est en défaut ( solution incolore).
Après l'équivalence il se trouve en excès ( apparition de la couleur
violette).
b. A l'équivalence, la quantité d'ion permanganate est 5 fois moins élevée que celle d'ion fer( II) initiale. Vrai.
c. La solution anti-chlorose diluée a une concentration égale à 2,0 10-2 mol / L. Vrai.
n(MnO4-aq) = C2 Véq = 5,0 10-3 x8,0 = 4,0 10-2 mmol.
n(Fe2+aq) =5 x4,0 10-2 = 0,20 mmol dans 10 mL soit 0,02 mol / L.
Tenir compte de la dilution, concentration de la solution avant dilution : 0,020 x 20 = 0,4 mol / L.
d. La teneur en fer est de 22,4 g / L. Vrai.
0,4 M(Fe) = 0,4 x 56 =22,4 g / L.
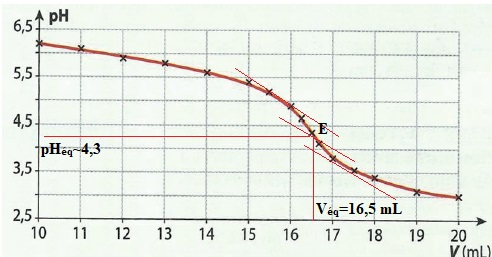
Exercice 7. alcalinité de l'eau d'une piscine.
On effectue le titrage pH-métrique de 50,0 mL d'eau par une solution d'acide chlorhydrique de concentration c = 2,0 10-2 mol / L.
Le pH de cette eau avant titrage est d'environ 8.
La TAC d'une eau correspond au volume ( en mL) d'une solution d'acide
chlorhydrique de concetration 0,020 mol/L nécessaire pour atteindre
l'équivalence lors du titrage de 100,0 mL de cette eau.
Le graphe pH=f(V) précise l'évolution du pH en fonction du volume V
d'acide chlorhydrique ajouté pour un volume supérieurà 10 mL.
a. Ce titrage
aurait pu être effectué par colorimétrie. Dans ce cas, l'indicateur le
plus approprié est le vert de bromocrésol ( zone de virage 3,8 ; 5,4).
Vrai.
La zone de virage de l'hélianthine ( zone de virage plus étroite 3,1 ; 4,4) contient le pH du point équivalent. L'hélianthine peut convenir.
b. Dans ce titrage, c'est l'espèce prédominante HCO3- qui réagit essentiellement avec l'acide chlorhydrique. Vrai.
HCO3- prédomine entre pH= 6,3 et pH = 10.
c. L'ion hydrogénocarbonate est une espèce ampholyte. Vrai.
d. Le TAC de cette eau est 16,5 °F. Faux.
16,5 x 2 = 33 °F.
Exercice 8. Analyse d'un protocole, synthèse éthanoate d'isopropyle.
Introduire dans un ballon muni d'un réfrigérant un volume VA = 8,8 mL de 3-méthylbutan-1-ol (A, M = 88 g / mol, masse volumique 0,80 g / mL), un volume VB
= 6,0 mL d'acide éthanoïque (B,M =60 g / mol, masse volumique 1,0 g /
mL) puis ajouter goutte à goutte un volume V = 4,0 mL d'acide
sulfurique concentré tout en refroidissant le ballon à l'aide d'un bain
de glace. Chauffer à reflux durant 15 minutes.
C5H11OH + CH3-COOH = C7H14O2 + H2O.
On donne 4 /3 ~1,3 ; 8,8 / 13 ~0,68 ; 1 /1,3 ~0,77 ; 0,68 / 1,3 ~0,53 ; 6,8 / 8 ~0,85.
a. L'acide sulfurique joue le rôle de catalyseur. Vrai.
b. La formule topologique du 3-méthylbutan-1-ol est :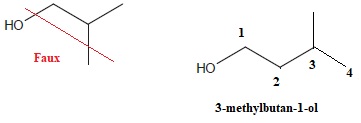
c. Le 3-méthylbutan-2-ol est l'énantiomère du réactif A. Faux.
Il s'agit d'un isomère de position de la fonction.
d. On obtient 8,8 g d'éthanoate d'isopentyle. Faux.
Masse de B : 6,0 g ; quantité de matière : 6,0 / 60 = 0,10 mol.
Masse de A :8,8 x0,8 g ; quantité de matière 8,8 x0,8 / 88 =0,08 mol ( en défaut).
On peut espérer au mieux obtenir 0,08 mol d'ester.
M(ester) = 7 x12 +14 +2x16 =130 g/mol.
Masse théorique d'ester : 0,08 x130 =10,4 g.
Exercice 9. Compétition entre mécanismes.
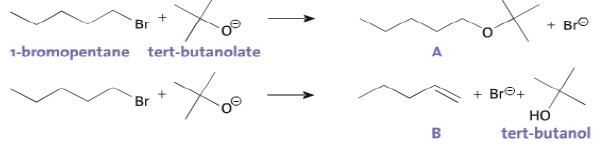
Le 1-bromopentane réagit avec l'ion tert-butanolate pour former deux composés A et B en proportions respectives 15 % et 85 %.
Le 1-bromopentane réagit avec l'ion éthanolatpour former deux composés C et B en proportions respectives 90 % et 10 %.
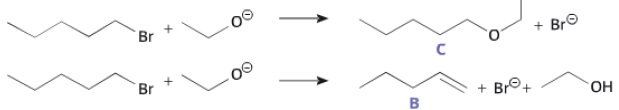
a. La réaction conduisant à la formation du composé A est une réaction de substitution. Vrai.
b. Le composé B présente deux diastéréoisomères. Faux.
Le mécanisme conduisant à la formation de A peut être décomposé en deux étapes :
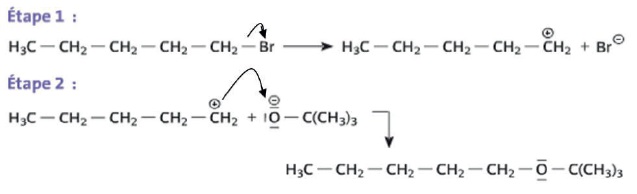
c. Dans l'étape 2, la flèche courbe symbolisant le transfert d'un doublet d'électrons est correctement représentée. Faux.
Elle doit avoir le sens inverse, du doublet vers le carbone +CH2.
d.
Un chimiste souhaite synthétiser du pent-1-éne ( composé B) à partir du
1-bromopentane. Il obtiendra un meilleur rendement avec l'ion
éthanolate. Faux.
Exercice 10. Synthèse d'un dipeptide.
La leucine et l'alanine sont deux acides aminés.
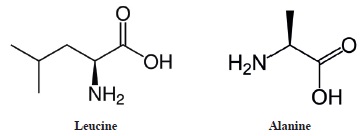
a. La Leucine et l'alanine sont deux molécules chirales. Vrai.
Toutes les deux possèdent un atome de carbone asymétrique.
On envisage la réaction entre l'alanine et la leucine.
b. Cette réaction peut conduire à 4 dipeptides différents. Vrai.
Ala-Ala ; Leu-Leu ; Ala-Leu ; Leu -ala.
Le protocole conduit au composé C suivant :
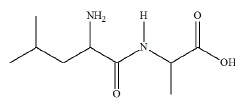
c. Lors de la formation de la fonction amide, il y a libération d'une molécule d'eau. Vrai.
d. Pour la synthèse de C, il a fallu protéger le groupe carboxyle de la leucine et le groupe amine de l'alanine. Faux.
Il a fallu protéger le groupe carboxyle de l'alanine et le groupe amine de la leucine.
|
|