Le
plomb, l'alliage 2024 cuivre aluminium. Concours interne ingénieur de
l'industrie et des mines.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
......
.....
|
A La
galène PbS, principal minerai de plomb.
1.
La galène possède une structure cubique faces centrées type NaCl. Faire
une figure.
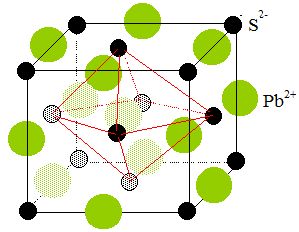
2. Déterminer le nombre d'unité(s)
PbS dans cette maille. Quelle est la coordinence cation-anion dans
cette maille ?
Chaque ion
situé au sommet du cube est commun à huit mailles, il compte pour
1/8.
Les ions situés sur les
huit sommets comptent pour 1/8 *8 = 1.
Chaque ion situé au
centre d'une face est commun à 2 mailles : il
compte pour 1/2.
Les 6 ions situés aux
centres des 6 faces comptent pour 1/2*6 = 3.
Les ions situés au milieu d'une arète appartiennent à 4 mailles et
comptent pour 1/4.
Les 12 ions situés aux milieux des arètes comptent pour 12 / 4 = 3.
L'ion central compte pour un.
Il y a donc 4 ions
sulfure et 4 ions Pb2+ par maille, soit 4 unité PbS par maille.
Coordinence ou nombre de plus proches voisins de
signe contraire = 6:
Chaque ions se trouve au centre d'un octaèdre dont les sommets sont
occupés par des ions de signe contraire.
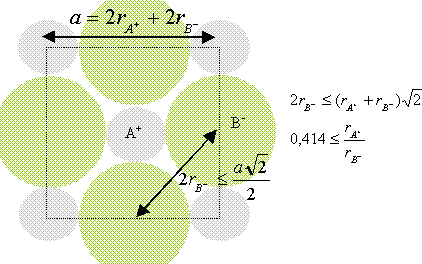
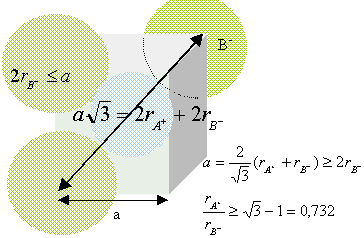
3. Donner la
valeur du paramètre a de la maille en utilisant les valeurs des rayons
ioniques et en supposant ce cristal ionique parfait.
a = 2r+ +2r- =2(120 +180) = 600 pm.
4. Calculer la valeur minimale des
rayons ioniques Rcation / Ranion pour ce type de
structure. Cette condition est-elle vérifiée pour la galène ?
Rapport des rayons ioniques du cation et de l'anion
dans cette structure : ( modèle des sphères dures)
conditions pour que AB cristallise
dans un réseau type NaCl :
Représentons une
section de la maille, les anions étant plus gros que les cations.
Rcation
/ Ranion =180 / 120 =0,67, valeur supérieure à 0,414.
5. La première
étape de la métallurgie de la galène consiste en un grillage de la
galène, à une température inférieure à la température de fusion, selon
la réaction (1) :
2 PbS(s) +3O2(g) --> 2 PbO(s) +2 SO2(g).
Calculer l'enthalpie standard ainsi que l'entropie standard à 300 K.
DrH° =2 DfH°( PbO(s)) +2 DfH°( SO2(g))-3 DfH°( O2(g)) -2 DfH°( PbS(s)).
DrH°
=2*(-220)+2*(-300) -3*0-2*(-120) = -800
kJ / mol.
DrS° =2 S°( PbO(s)) + 2S°( SO2(g))-2 S°( PbS(s)) -3 S°( O2(g)).
DrS°
=2*65+2*250-2*90-3*205 = -165 J mol-1
K-1.
L'accumulateur
au plomb.
Chaine électrochimique.
- Pb(s)
/ PbSO4(s) / solution aqueuse d'acide sulfurique / PbSO4(s) / PbO2(s) /
Pb(s) +.
1. Quel est le rôle
de la solution d'acide sulfurique dans cet accumulateur.
Cet acide, conducteur électrique, joue le rôle d'électrolyte.
2. Comparer, de
façon
qualiitative, les solubilités du sulfate de plomb dans l'eau et dans
une solution aqueuse d'acide sulfurique.
Dans l'eau à 25 °C, la solubilité du sulfate de plomb est de l'ordre de
10-4 mol / L.
Une solution d'acide sulfurique apporte des ions sulfate. Par effet
d'ion commun, la solubilité du sulfate de plomb diminue dans une
solution d'acide sulfurique.
3. Ecrire
l'équation de la réaction de fonctionnement en décharge de cet
accumulateur.
Réduction de PbO2(s) à la
cathode positive : PbO2(s)
+4H+aq +2e- = Pb2+aq
+ 2H2O.
Oxydation
du plomb à l'anode négative : Pb(s) = Pb2+aq
+ 2e-.
Ajouter : PbO2(s)
+4H+aq +2e- +Pb(s)
= 2Pb2+aq
+ 2H2O+
2e-.
Simplifier : PbO2(s)
+4H+aq +Pb(s)
= 2Pb2+aq
+ 2H2O.
4. Calculer la
valeur de la force électromotrice standard à intensité nulle de cet
accumulateur. Commenter.
E1 =
E°(Pb2+aq
/ Pb(s)) +0,03 log [Pb2+aq].
E2 =
E°(PbO2(s) / Pb2+aq) +0,03 log ([H+aq]4 / [Pb2+aq]).
E
=E2 - E1 =E°(PbO2(s)
/ Pb2+aq) -E°(Pb2+aq
/ Pb(s)) +
0,03 log ([H+aq]4 / [Pb2+aq]2 ).
E
= 1,45 -(-0,15) +0,03 log(1/ (1,0 10-12))=1,60 +0,36 = 1,96
~2,0 V.
Dans une batterie de voiture ( E =12 V ), 6 accumulateurs sont donc
associés en série.
La courbe intensité-potentiel suivante représente l'intensité
surfacique J ( A / m2)
par unité de surface de l'électrode de plomb, en fonction de E ( V)
imposé à cette électrode. L'électrode de plomb plonge dans une solution
aqueuse désaérée ( pas de dioxygène dissous) d'acide sulfurique de pH
~0 et de température 300 K. Les ions sulfate ne sont pas
électro-attractifs.
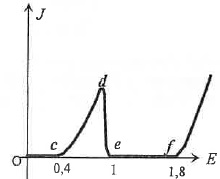
5. Commenter les
réactions électrochimiques correspondant aux parties (0c) et (cd).
Partie (0c), l'intensité est nulle : pas de réaction d'oxydation.
Partie (cd) : oxydation du plomb en PbO2(s).
6. Quel phénomène
intervient sur la partie (de) pour annuler l'intensité ?
Passivation de l'électrode de plomb par PbO2.
7. Ecrire
l'équation de la réaction électrochimique correspondant à la
partie au-delà du point f.
Oxydation de l'eau en dioxygène
H2O -->½O2(g)+2H+(aq)
+2e-
8. Pourquoi est-il
nécessaire de ne pas dépasser une tension limite lors de la charge de
l'accumulateur si celui-ci est scellé ?
Il vaut mieux qu'il n'y ait pas de dégagement de gaz dans une enceinte
scellée.
|
...
|
|
|
....
|
L'alliage
2024.
Séparation du cuivre et de
l'alluminium.
On réduit en poudre m0 = 1 g
d'alliage cuivre aluminium. Cette poudre est introduite dans un balon
de 250 mL. On verse ensuite 100 mL de solution de soude à environ 8 mol
/ L sur l'alliage. Quand le dégagement gazeux de dihydrogène tend à
diminuer, le contenu du ballon est porté à ébullition pendant 15 min.
Après refroidissement, le contenu du ballon est filtré. Les particules
solides restées sur le filtre sont rincées, puis placées dans un becher.
1. Pourquoi utilise
t-on l'alliage sous forme de poudre ?
La poudre est très divisée, grande de surface d'échange avec la soude :
cela augmente beucoup la vitesse de la réaction
2. Les diagrammes
potentiel - pH sont tracés pour les éléments Al et Cu à une
concentration de 0,010 mol / L sur chaque frontière. Les frontières
associées aux couples de l'eau sont tracées en traits plus fins.
Reproduire celui de Al avec H2O et attribuer un dommaine à
chaque espèce : Al(s), AlO2-, Al3+aq
et Al(OH)3 (s).
3. Retrouver le pH d'apparition du
solide Al(OH)3.
Al(OH)3 (s) = Al3+
aq+ 3HO- aq : Ks
= [Al3+][HO-]3=10-32 ;
[Al3+] = 10-2 mol/L.
[HO-]3=10-32 /10-2
= 10-30 ; [HO-]
= 10-10 ;
pH= 14 + log [HO- ] = 14+log 10-10
=4.
4. Déterminer la
valeur théorique de la pente de la frontière séparant les domaines de
stabilité de Cu2+aq et Cu2O(s).
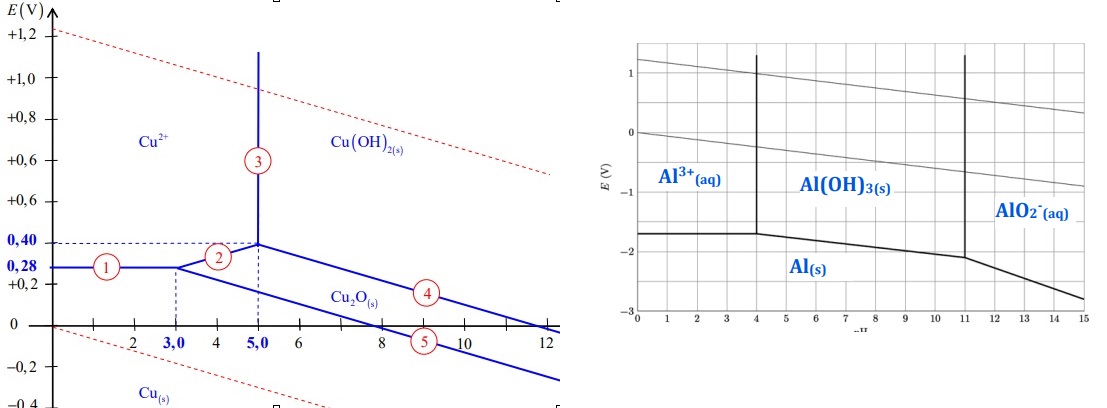
2Cu(s)
+ H2O --> Cu2O(s) +2H+aq +2e-.
E = E°(Cu2O /Cu) +0,03 log [H+aq]2 =E°(Cu2O
/Cu) +0,06 log [H+aq]
= E°(Cu2O
/Cu) -0,06 pH.
Pente de cette droite frontière : -0,06.
5. A partir des
diagrammes, justifier l'utilisation du traitement par la soude pour
séparer les éléments aluminium et cuivre. Ecrire la ( les ) réaction(s)
qui ont lieu au cours de cette phase.
En milieu très basique, l'eau et Al se trouvent dans des domaines
disjoints :
2Al(s) + 2H2O +2HO-aq -->2AlO2-aq
+3 H2(g)..
Par contre le cuivre Cu(s) et l'eau ont un domaine de stabilité commun
en milieu basique. Le cuivre ne sera pas attaqué.
6. Pourquoi est-il
judicieux de porter le mélange à ébullition quand le dégagement gazeux
faiblit ?
La température est un facteur cinétique. En chauffant on augmente la
vitesse de la réaction. L'oxydation se termine plus rapidement.
2ème
étape : dissolution du cuivre.
Le solide Cu(s) récupéré à l'issue de la première étape est totalement
dissout au moyen de V= 10 mL d'acide nitrique concentré ( H+aq
+NO3-aq ). NO se dégage.
Ecrire l'équation de cette réaction.
3 fois { Cu(s) --> Cu2+aq + 2e- }
2 fois { NO3-aq + 3e- +4H+aq
--> NO(g) +2H2O }
2NO3-aq
+ 6e- +8H+aq +3 Cu(s)--> 2NO(g) +4H2O
+3Cu2+aq
+ 6e- .
2NO3-aq
+8H+aq +3 Cu(s)--> 2NO(g) +4H2O +3Cu2+aq
.
Dosage du cuivre dans
l'alliage.
Après addition d'un excès diodure de potassium, la solution prend une
coloration brune due à la formation de diiode I2. Ce dernier
est dosé par une solution de thiosulfate de sodium 2 Na+aq +S2O32-aq
de concentration C1 =0,050 mol / L. L'équivalence est
détectée pour un volume versé VE = 12,5 mL.
2 Cu2+aq +4I-aq --> CuI(s)+I2 aq.
(R2)
2S2O32-aq
+I2
aq --> S4O62-aq
+ 2I-aq.
(R3)
1. Justifier par un
calcul le caractère total de la réaction (R3) de constante d'équilibre
K.
K = [S4O62-
] [I-
]2 / ([S2O32-
]2 [I2
] ).
E (I2 / I- ) =0,62 V ; E( S4O62-
/S2O32-
) =0,08 V.
E1 = 0,62 + 0,03 log ([(I2
/ /[I- ]2).
E2 = 0,62 +0,03 log ( [S4O62-
] / [ S2O32-]2
).
E2
-E1
= 0,62 -0,08 +0,03 log K ; log K = 0,54 / 0,03 =18 ; K = 1018.
La réaction est donc totale.
Remarque
: quand la différence des deux potentiels est supérieure à 0,3 V, la
réaction est totale.
2. Exprimer la
quantité de matière de diiode formé en fonction de la quantité initiale
de Cu2+.
n(I2) = 0,5 n(Cu2+).
3. Ecrire la
relation traduisant l'équivalence ( R3).
0,5 C1 VE =[I2] V.
4. En déduire le
pourcentage massique du cuivre dans l'alliage.
n(I2)
=[I2] V =0,5 x12,5 x 0,050 =0,3125 mmol.
n(Cu2+)=
0,3125 x 2 = 0,625 mmol.
Masse correspondante : 0,625 M(Cu) = 0,625 x 63,5 ~39,7 mg dans 1,0 g
d'alliage ( ~ 4,0 %)
5. Pourquoi serait-il utile de
répéter une nouvelle fois ce dosage ?
Faire deux titrages permet de
vérifier que les deux résultats concordent.
|
|