Propriétés
du mercure. Concours interne ingénieur de
l'industrie et des mines 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
......
.....
|
A Structure cristalline.
Le minerai le plus important est le cinabre de formule HgS. La variété dite ß a la structure suivante.
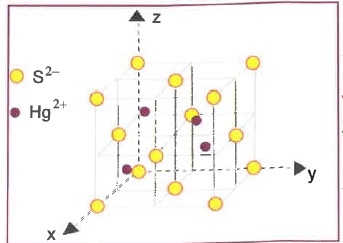
1. Décompter le nombre de Hg et le nombre de S par maille.
Chaque ion
S2- situé au sommet du cube est commun à huit mailles, il compte pour
1/8.
Les ions situés sur les
huit sommets comptent pour 1/8 *8 = 1.
Chaque ion S2- situé au
centre d'une face est commun à 2 mailles : il
compte pour 1/2.
Les 6 ions situés aux
centres des 6 faces comptent pour 1/2*6 = 3.
Les ions Hg2+ occupent la moitié de sites tétraèdriques.
Total : 4 ions S2- et 4 ions Hg2+ par maille.
2. Etablir la relation entre le paramètre de la maille a et la masse volumique r.
Volume de la maille V = a3.
Masse des atomes : m = 4 (mHg +mS)= 4 M(HgS) / NA.
Masse volumique : 4 (mHg +mS) / a3.
3. On donne a = 650 pm, en déduire le rayon r(Hg2+) dans cette structure sachant qu'il y a contact entre Hg et S et que ce dernier a un rayon atomique r(S2-) = 170 pm.
Il y a contact entre deux ions ( supposés sphériques ) de mercure et de soufre sur un quart de la grande diagonale du cube.
La grande diagonale mesure : 3½a.
r(Hg2+) +r(S2-) = 3½a / 4.
r(Hg2+) = 3½ x 650 / 4 -170 =111 pm.
B. Cinétique de la réduction : 2 Fe2+ +2Hg2+ = Hg22++2Fe3+.
On propose une loi cinétique de la forme v = k [Fe2+]p [Hg2+]q. On suit le quotient x = [Hg2+] / [Hg2+]0 par spectrophotométrie.
Expérience1. [Fe2+]0 = [Hg2+]0.
t(min)
|
0
|
1
|
2
|
3
|
oo
|
x
|
1
|
0,50
|
0,33
|
0,25
|
0
|
Expérience2. [Fe2+]0 =100 [Hg2+]0.
t(min)
|
0
|
1
|
2
|
4
|
oo
|
x
|
1
|
0,66
|
0,45
|
0,20
|
0
|
1. Montrer que l'ordre global de la réaction est 2.
2 Fe2+ +2Hg2+ = Hg22++2Fe3+.
Moles : N0-2x N0-2x x 2x
Vitesse volumique v = dx / dt = -0,5 d[Hg2+] /dt = k [Fe2+]p [Hg2+]q.
Or (Fe2+] =[Hg2+].
v = -0,5 d[Hg2+] /dt = k [Hg2+]p+q .
On a ainsi accès à l'odre global p +q.
Dans l'hypothèse d'un ordre global égal à 2.
-0,5 d[Hg2+] /dt = k [Hg2+]2 .
-d[Hg2+] / [Hg2+]2 = 2 k dt.
Par intégration : 1 / [Hg2+] -1 / [Hg2+]0 =2kt.
1 / x -1 =2k [Hg2+]0 t.
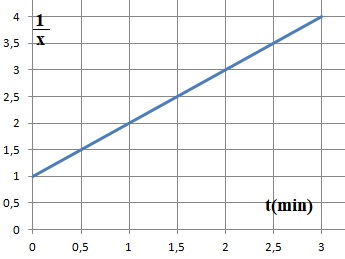
Les données de l'expérience 1 sont en accord avec un ordre global égal à 2.
2. Montrer que l'on peut raisonnablement estimer que p = q = 1.
2 Fe2+ +2Hg2+ = Hg22++2Fe3+.
Moles : N0-2x N0-2x x 2x
N0-2x ~N0. [Fe2+] ~[Fe2+]0 = constante.
On pose k' = k [Fe2+]p
Vitesse volumique v = -0,5 d[Hg2+] /dt = k' [Hg2+]q.
Méthode dite de la dégénérescence de l'ordre. On a accès à l'ordre partiel q.
Dans l'hypothèse où q = 1 :
d[Hg2+] / [Hg2+] = - 2 k' dt.
ln([Hg2+] / [Hg2+]0) = -2k' t ; -ln(x) = 2k' t.
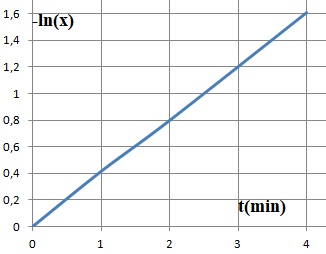
Les données de l'expérience 2 sont en accord avec un ordre partiel p=q= 1.
|
...
|
|
|
....
|
Grillage du sulfure : HgS(s) + O2(g) = Hg(g) + SO2(g).
Le système est formé initialement d'une mole de HgS et d'une mole de dioxygène fournie par l'air ambiant.
1. Déterminer la constante d'équilibre à 700 °C connaissant l'enthalpie libre standard de réaction DrG0(973 K) =-309 kJ / mol. Justifier que la réaction est quantitative.
DrG0(973 K) = -RT ln (K) ; ln(K) = 3,09 105 / (8,314 x 973) =38,2 ; K =3,9 1016.
HgS(s) + O2(g) = Hg(g) + SO2(g).
Moles : 1-x 1-x x x
K = [x / (1-x)]2 ; x / (1-x) = (3,9 1016)½ ~ 2 108.
x = 2 108(1-x) ; x ~1.
K étant très grand, la réaction est quantitative.
L'oxyde HgO(s) peut se former lors du grillage. Les équations considérées sont :
2 Hg(l) +O2(g) = 2HgO(s). (1)
2 Hg(g) +O2(g) = 2HgO(s). (2)
On donne le diagramme d'Ellingham indiquant les variations d'enthalpie
libre standard de la réaction d'oxydation du mercure, ramenée à une
mole de dioxygène gazeux.
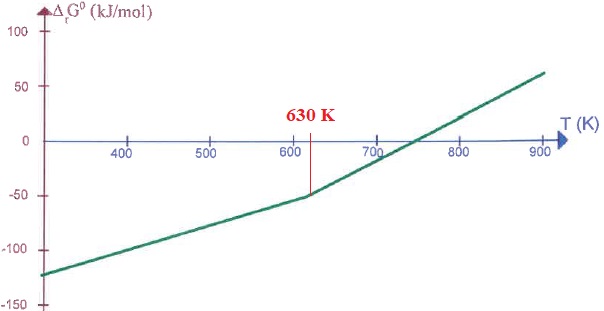
2.
Déterminer la condition sur la température pour favoriser l'obtention
de mercure (gaz) à partir de l'oxyde. Vérifier par le calcul.
On trace DrG0 (T)= DrH0 (T)- T DrS0(T).
DrH0 (T) et DrS0(T) sont considérés comme indépendants de la température.
Droite d'ordonnée à l'origine DrH0 et de pente -DrS0 .
Si un réactif ou un produit change d'état physique à pression constante, on observe une rupture de pente.
Discontinuité de DrH0 due à la chaleur latente de changement d'état ) : D(DrH0)
Discontinuité de DrS0 : D(DrS0)
DrG0 (T) ne varie pas, le changement d'état s'effectuant de manière réversible.
Tchangement état =D(DrH0) / D(DrS0).
Aux températures plus basses, le mercure est à l'état liquide ; aux température plus élevées, le mercure est gazeux.
Pour la réaction (1) :
DrH0 (T) =2 DfH0 (HgO(s)) -2 DfH0 (Hg(l))- DfH0 (O2(g))
DrH0 (T) =2 x(-91)= -182 kJ / mol.
DrS0 (T) =2 DfS0 (HgO(s)) -2 DfS0 (Hg(l))- DfS0 (O2(g))
DrS0 (T) =2 x70-2 x76 -205= -217 J K-1mol-1.
Pour la réaction (2) :
DrH0 (T) =2 DfH0 (HgO(s)) -2 DfH0 (Hg(g))- DfH0 (O2(g))
DrH0 (T) =2 x(-91)-2 x 59= -300 kJ / mol.
DrS0 (T) =2 DfS0 (HgO(s)) -2 DfS0 (Hg(g))- DfS0 (O2(g))
DrS0 (T) =2 x70-2 x170 -205= -405 J K-1mol-1.
Tchangement état =(300-182) 103 / (405-217) ~627 K.
Expression de DrG°2(T) pour la réaction 2 :
DrG°2(T)= -300 103 +405 T
P(O2) est fixée à 0,2 bar ( dioxygène de l'air).
A l'équilibre on fixe PHg éq > 1 bar ; PO2 éq =0,2 bar.
1 / K '=(PHg / P0)éq2 (P(O2)/P0)éq > 0,2.
K ' > 5.
DrG°2(T)= -RT ln K ' .
-300 103 +405 T > -8,314 T ln(5).
405 T+13,38 T >300 103 ;
T > 717 K.
3.
Dans une enceinte vide de volume V = 10 L, on introduit 2 mol de HgO et
on chauffe à T = 480 °C. Déterminer le taux de dissociation de HgO à
l'équilibre.
T = 480 +273 = 753 K.
Cette valeur étant supérieure à 717 K, le mercure est gazeux.
2HgO(s) =2 Hg(g) +O2(g).
DrG°2(T) =300 103 -405 T =300 103 -405 x753 = -5 103 J / mol.
DrG°2(T) =- RT ln K" ; ln K" =5 103 / (8,314 x 753) =0,79 ; K" =2,2.
|
2HgO(s)
|
=2Hg(g)
|
+O2(g)
|
moles à l'équilibre
|
n-2x
|
2x |
x |
activité à l'équilibre
|
1
|
2x RT / (P0V)= 2p / P0
|
x RT / (P0V) = p /P0
|
K" = p / P0 (2p/P0)2= 4 p3 / P03 = 2,2 avec P0 = 1 bar.
p =(2,2 / 4)1/3 ~ 0,82 bar = 8,2 104 Pa.
x =pV / (RT) =8,2 104 x10 10-3 /(8,314 x753)~ 0,13 mol.
HgO (s) restant à l'équilibre 2 -2 x0,13 = 1,74 mol.
Le taux de dissociation est le pourcentage d'espèces qui se dissocient, soit 13 %.
|
|



