Chimie
analytique, concours interne technicien principal police technique et
scientifique 2015.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Partie A.
1. Définir brièvement le rôle des intervenants.
Pompiers : secours aux victimes et incendies.
Démineurs : intervention sur une bombe, sécuriser la zone.
OPJ : constater les infractions, rassembler les preuves, mener l'enquète.
Service d' identité judicière : recueillir, conserver et présenter des
éléments de preuves, coordonner ses compétences avec celles de
l'enquéteur.
Section I E : recherche des causes des incendies explosions, d'hydrocarbures et explosifs.
2.
Proposer au moins deux éxamens et/ou analyses complémentaires que le
laboratoire pourrair réaliser sur les prélevements effectués.
L'analyse d'urine et l'analyse de sang fournissent des informations à
court terme de la consommation de drogues. L'histoire à long terme
n'est possible que par l'analyse des cheveux ( distinction entre
l'utilisation chronique et d'une exposition unique aux drogues ).
Partie B.
Détermination de l'alcoolémie.
Le dosage de l'alcool éthylique dans le sang est réalisé par
chromatographie en phase gazeusz couplée à un détecteur par ionisation
de flamme. Sur deux prises d'essais de 500 µL, on ajoute 5,0 mL
d'étalon interne, le tert-butanol ( tBuOH).
Avant la mesure, on effectue un étalonnage interne en 6 points à partir
de deux mesures aux concentrations de 0,10 ; 0,20 ; 0,50 ; 1,0 ; 2,0 et
3,0 g / L sur 800µL additionné de 5,0 mL de ter-butanol.
3. Quel est le rôle de l'étalon interne ?
Cette technique permet de s'affranchir complètement des volumes injectés.
Elle
est relativement longue à mettre en oeuvre. L'étalon interne n'est pas
facile à trouver : il doit avoir une structure chimique proche des
solutés analysés, ne pas interférer avec les solutés, ne pas réagir
chimiquement avec d'autres constituants présents et doit être
compatible avec le système de détection.
Le pic de l'étalon interne sert d'échelle.
4. La relation Aire EtOH / Aire tBuOH = f(C) est-elle linéaire ? Sur quel domaine ? Justifier.
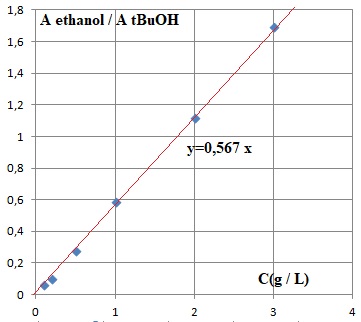
La
relation Aire EtOH / Aire tBuOH = f(C) est linéaire sur 0 ; 3 g /L. Les
points sont alignés sur une droite passant par l'origine.
5. Déterminer la concentration en g / L d'alcool éthylique dans le sang de M Dupont ?
Rapport des aires : prise n°1 : 34 195 / 59 810 = 0,572.
Prise n°2 : 33 122 / 59 954 ~0,522. Moyenne : 0,547.
Par suite : 0,547 / 0,567 =0,965 g / L.
6. Au volant d'un véhicule, Mr Dupont serait-il en infraction ? Si Oui, de quel type d'infraction ?
0,965 est supérieur à 0,5 g/L : il y a donc infraction.
Il s'agit d'un délit ( 0,965 est supérieur à 0,8 g/L )
Recherche et dosage de stupéfiants.
Recherche d'opiaciés et de cocaïniques.
L'extraction liquide-liquide du sang met en oeuvre un mélange de dichlorométhane / isopropanol 90 / 10 v / v.
7.
Que signifie le pictogramme suivant ?

Cancérogène, tératogène.
8. Quels sont vos protections individuelles lors de la manipulation ?
Protection des yeux et du visage : lunette, écran facial.
Protection de la peau : gants, tabliers, bottes.
Protection des voies respiratoires : appareil respiratoire autonome muni d'un masque complet.
9. A la fin de
votre manipulation, vous voulez jeter le reste de votre mélange. Vous
disposez de trois bidons à déchets étiquetés : CMR halogénés ; Non CMR
halogénés ; Nom CMR Non halogénés. Quel bidon utilisez-vous ?
Bidon CMR halogénés.
Recherche de cannabinoïdes.
Le THC est la molécule psychoactive présente abondamment dans le canabis. Il est métabolisé en acide THC-COOH.
10. Qu'est-ce q'un métabolite ? Quelles indications peut fournir leur présence ?
Un métabolite est un composé organique intermédiaire ou issu du
métabolisme. Ce terme est réservé aux petites molécules ( monomère) par
opposition aux macromolécules. Par exemple le glucose est un
métabolite, contrairement au glycogène.
La présence des molécules mères retrouvées dans la salive, révèlent la consommation des 24 dernières heures.
11. Donner la formule semi-développée ou topologique du THC-OH et THC-COOH.
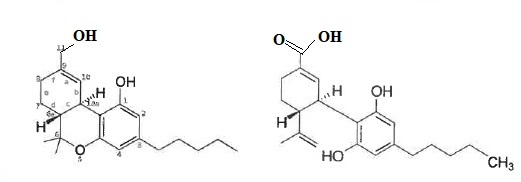
12. Citez au moins 2 mesures pour prévenir la contamination inter-échantillons.
Utiliser des contenants exempts de contaminants.
Les réactifs utilisés pour les mesures doivent être maintenus dans un endroit propre, sec, aéré, à l'abri de la lumière.
Refermer correctement les flacons de réactifs après usage.
Ne pas mettre les doigts hulides sur les flacons de réactifs.
Vérifier la date d'expiration des produits.
13. Dans quel but les composés deutérés sont-ils ajouter au prélevement ?
Les produits deutérés servent de substance étalon.
14. Quel est l'apport de la silylation sur les composés cibles ?
L'introduction d'un groupe silyle substitué R3Si- dans une
molécule ( remplacement d'un hydrogène acide) conduit à un dérivé moins
polaire, plus volatil, plus stable thermiquement. En spectrométrie de
masse, les fragements sont plus facilement identifiables.
15.
Préciser les masses scannées utilisées pour vérifier l'absence d'air
dans le système GC/MS. Quelles interventions simples préconisez-vous
en cas de présence d'air dans le spectrophotomètre ?
Les signaux attribuables à H2O, N2, O2 et CO2
( substances introduites par une fuite d'air ) sont exprimés sous forme
de rapport par rapport à un autre ion constant ( par exemple 69, l'un
des trois ions principaux du PFTBA sur lesquels s'accorde l'instrument
).
Purger le système.
Une source courante de fuite est la virole reliant la colonne à la ligne de transfert.
16. Donner le principe du TUNE ( réglage du spectrophotomètre de masse ).
Le spectrophotomètre se règle à partir du PFTBA (
perfluorotributylamine) , dont les caractéristiques spectrales sont
parfaitement connues. Ce produit est stable, volatil. Les fragments
sont répartis sur une large gamme de masse / charge. Les masse / charge
de référence sont 69, 131, 219, 414, 502, 614. Les rapports de
fragmentation sont calculés à partir du pic 69 ( 100 %).
Le système commence une optimisation de chacun de ces paramètres.
La méthode d'analyse des cannabinoïdes utilise les modes SCAN et mode SIM.
17. Que signifie SIM ? Quelle est la différence entre ces deux modes ?
SCAN : l'analyseur est scanné de manière séquentielle et passe chaque m /z dans la gamme sélectionnée vers le détecteur.
SIM : un ion cible de rapport m / z donné est recherché. Seuls les ions ayant ce rapport m / z passe dans le détecteur.
Les masses ( m / z) examinées sont reportées dans le tableau suivant :
|
Ion de quantification
|
Ion de confirmation
|
THC-(TMS)
|
386
|
303-371
|
D3THC- (TMS)
|
389
|
306-374
|
18. A quoi correspond le fragment de masse 386 du THC-(TMS) ?
Les deux groupes OH du THC ont été transformés en ester par CH3COOH.
19. Calculer la concentration en ng / mL de THC dans le sang.
Ion à m/z = 386 : aire du pic : 4906 ; ion à m / z = 389 : aire du pic : 18874. Rapport des aires :0,26
Ion à m/z = 303 : aire du pic :3853 ; ion à m /z = 306 : aire du pic : 12871. Rapport des aires :0,30.
Ion à m/z = 371 : aire du pic :5517 ; ion à m /z = 374 : aire du pic : 21922. Rapport des aires : 0,25.
Valeur moyenne du rapport des aires : ~0,27.
Concentration des composés deutérés : 1 µg / mL.
Concentration de THC dans le sang : 1 x0,27 = 0,27 µg / mL ou 270 ng / mL.
Partie C. Incendie - explosion.
20. Donner la formule topologique du TATP ou peroxyde d'acétone.
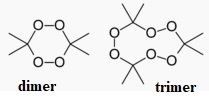
21. Que signifie Head Space ( HS) ? A quel type de composés ce type d'extraction est-il adapté ?
Extraction
par sorption dans l'espace de tête. Il s'agit d'identifier les composés
odorants dans l'air environnant divers objets, liquides ou solides dans
un flacon. Les objets odorants d'intérêt sont les plantes, les fleurs,
les aliments et leurs emballages.
22. Citer d'autres exemples d'analyses utilisant cette technique.
Les analyses courantes concernent les composés organiques volatils
provenant des eaux usées, des échantillons de terre, pour les
solvants résiduels dans les emballages, pour le dépistage d'alcoolémie
et de toxicologie, pour les composés aromatiques des aliments et
boissons, pour l'analyse de gaz à partir d'huiles.
23. Expliquer le principe de l'extraction HS/SPME.
L'échantillon est chauffé dans un vial fermé, la fibre est ensuite
introduite dedans et n'est exposée qu'à la partie gazeuse de
l'échantillon. Un échantillon de gaz de l'espace de tête est injecté
dans un système GC pour la séparation des composants volatils.
24. Sur le spectre du TATP, à quels fragments correspondent les masses m/z = 43, 58 et 221,1 ?
m/z = 43 : CH3-CO ; m/z = 58 : (CH3)2CO ; m/z = 221,1 : pic moléculaire du trimer.
25.
Le scellé n°5/4 ( restes d'un récipient en céramique) subi une
extraction par solvant en plus de l'extraction HS/SPME. Quel solvant
utilisé parmi : eau, acétone, méthanol ?
La technique analytique GC/MS met en évidence le TATP et le camphre.
La technique analytique CCM met en évidence la nitrocellulose.
La nitrocellulose est très soluble dans l'acétone.
26. Dans quel ordre les deux extractions sont-elles effectuées ? Pourquoi ?
Le camphre étant soluble dans l'acétone, la première extraction est GC/MS.
27. Scellé n°3 : bouteille
plastique. Quel acide renfermait la bouteille du scellé n°3/4 ? Quel
test a été réalisé pour mettre en évidence les ions chlorure ?
pH=0 et présence d'ion chlorure : acide chlorhydrique.
Le test au nitrate d'argent met en évidence les ions chlorure.
28. Citer une autre technique analytique permettant de confirmer la présence des ces ions ?
Electroanalyse, titrage.
29.
Cet acide est-il fort ou faible ? Quel est son rôle dans la synthèse du
TATP ? A défaut de cet acide, citer deux autres acides utilisables.
L'acide chlorhydrique est un acide fort. Il joue le rôle de catalyseur.
On peut utiliser d'autres acides forts, acide nitrique, acide sulfurique.
30. Ecrire la réaction de synthèse du TATP.
2H2O2+ 2H3C-CO-CH3 --> C6H12O4 ( dimer) +2 H2O.
3H2O2+ 3H3C-CO-CH3 --> C9H18O6 ( trimer) +3 H2O.
31. Montrer
que : titre volumique de l'eau oxygénée = 11,2 x concentration en mol / L.
H2O2(l) --> H2O(l) + ½O2(g).
Quantité de matière de H2O2 dans 1 L de concentration C mol / L : C.
Quantité de matière de dioxygène libérée ½C mol.
Volume molaire des gaz dans ces conditions : 22,4 L / mol.
Volume de dioxygène : 22,4 x ½C = 11,2 C.
32. 158,06 g de TATP ont été synthétisés. Calculer les quantités de réactifs nécessaires à cette synthèse.
M(TATP trimère) =222 g / mol ; quantité de matière TATP : 158,06 / 222 = 0,712 mol.
Quantité de matière acétone = quantité de matière eau oxygénée = 3 x0,712 =2,136 mol.
Eau oxygénée à 130 volumes : C =130 / 11,2 =11,61 mol / L.
Volume nécessaire : 2,136 / 11,61 ~0,184 L = 184 mL
Acétone (d = 0,783) ; M= 58 g/mol ; masse : 58 x 2,136 =123,9 g ; volume : 123,9 / 0,783 ~ 158 mL.
33. Quelle quantité maximale de TATP peut être synthétisée à partir d'un litre d'eau oxygéne à 130 volumes et 1 L d'acétone.
L'eau oxygénée est le réactif limitant.
1 / 0,184 x 158,06 ~859 g.
34. Expliquer la présence de nitrocellulose et de camphre au sein des prélevements.
La nitrocellulose et le camphre stabilisent le TATP et permettent de le mouler..
|
...
|
....
|
Hygiène et sécurité.
1. Que signifie CMR ?
Cancérogène, Mutagène, Toxyque pour la reproduction
2. Que signifie SST ?
Sauveteur, Secouriste du Travail
3.
Que doit-on faire en cas de brûlures légères par un acide ?
Lavages à grande eau.
4. Que signifie les
pictogrammes suivants :

Dosage des ions nitrates dans un engrais.
Pour préparer une solution de fer (II), on pèse 7,845 g de sel de Mohr
( Fe(NH4)2(SO4)2,6H2O)
que l'on dissout dans une fiole jaugée de 100 mL en ajoutant de l'eau
distillée et de l'acide sulfurique.
Calculer
la concentration en ion fer (II) de cette solution.
M( sel de Mohr) = 55,85 +28+8+2(32+4*16)+6*18=391,85 g/mol ; n( sel de
Mohr) = n(Fe2+) =7,845 / 391,85 =2,002 10-2
mol.
[Fe2+] =c2 =2,002 10-2
/0,100 = 0,200 mol/L.
On pèse 1,25 g d'engrais que l'on dissout dans 100 mL d'eau distillée.
Soit V0
le volume de cette solution. On porte à ébullition en milieu acide, une
masse connue d'engrais en présence d'une quantité connue et en excès
d'ion fer (II). Une partie de ces ions fer (II) sont oxydés tandis que
les ions nitrate sont réduits en monxyde d'azote.
Sachant que
les couples oxydant / réducteur mis en jeu sont Fe3+
aq / Fe2+aq
et NO3- aq
/ NO(g) en
déduire l'équation de la réaction entre les ions nitrate et les ions Fe2+.
Oxydation
de Fe2+aq : 3 Fe2+aq
=3 Fe3+aq + 3e-.
Réduction
de NO3- aq
: NO3- aq
+ 4 H+aq+ 3e- =
NO(g) + 2H2O(l).
Ajouter ces
deux demi-équations, puis simplifier.
4 H+aq
+ NO3-
aq +3Fe2+aq
= NO(g) + 2H2O(l) + 3 Fe2+aq.
(1)
En
déduire la relation entre les quantités de matière d'ion fer (II) et
nitrate.
n(Fe2+)
= 3 n(NO3- ).
Les ions fer (II) en excès sont dosés par une solution de
permanganate de potassium de concentration c3.
Ecrire
les deux demi-équations puis le bilan de ce dosage dit en retour.
Donner la relation entre les quantités de matière d'ion fer (II) en
excès et d'ion permanganate.
5 Fe2+aq
=5 Fe3+aq + 5e-.
MnO4- + 8H+
+5e- =Mn2+ + 4H2O.
MnO4-
+ 8H+ +5 Fe2+aq =Mn2+ + 4H2O
+5 Fe3+aq.
n(Fe2+) excès
= 5n(MnO4-).
On place dans un erlenmeyer V1 = 10 mL de la
solution d'engrais et V2 = 10 mL de la solution
de sel de Mohr. On ajoute environ 10 mL d'acide sulfurique dilué. On
chauffe et on maintient l'ébullition une dizaine de minutes. On
refroidit, puis on dose l'excès d'ion fer (II) par la solution de
permanganate de potassium de concentration c3 =1
/ 50 mol/L placée dans la burette. Le volume équivalent versé est V3
=9,1 mL.
Exprimer
la concentration en ion nitrate [NO3-] en
fonction de V1, V2,
V3, C2 et C3.
Faire
l'application numérique.
n(MnO4-) =c3
V3
; n(Fe2+)
excès =5c3 V3 =5 / 50 * 9,1 = 0,91 mmol.
n(Fe2+)total =c2V2
=0,200 * 10 = 2,0 mmol.
n(Fe2+)
ayant réagi avec nitrate =n(Fe2+)total
-n(Fe2+)
excès=c2V2
-5c3 V3 =2,0-0,91 = 1,09 mmol.
n(NO3-
) = n(Fe2+) ayant
réagi avec nitrate /3 =(c2V2
-5c3 V3)/3 =1,09 / 3 = 0,363 mmol.
[NO3-
]= n(NO3- ) / V1
=(c2V2
-5c3 V3) / (3 V1)=0,363 / 10
= 0,0363 ~0,036 mol/L.
Calculer
la masse d'azote contenue dans la solution préparée, sous forme de
nitrate. Calculer le pourcentage en élément azote dans cet engrais.
Quantité de matière d'ion nitrate dans 100 mL : [NO3-
]*0,100 = 3,63 10-3 mol.
Masse d'élément azote : 14*3,63 10-3 =0,050867
~0,051 g soit 0,050867 /1,25*100 ~4,1 %.
|
|




