Le
2,5-diméthylfurane un carburant d'avenir,
enseignement de spécialité, classe de première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
.
..
.....
|
Problématique.
À eux seuls les transports représentent un quart de la consommation
d’énergie et un quart des émissions de gaz à effet de serre en France.
De nombreuses recherches sont conduites pour produire des carburants de
substitution aux carburants conventionnels issus du pétrole, afin de
limiter les émissions de gaz à effet de serre tels que le dioxyde de
carbone. Ainsi des « agrocarburants » sont produits à partir de matière
organique d’origine végétale, c’est le cas du « bioéthanol » qui est de
l’éthanol obtenu par transformation de glucides issus de la betterave,
du blé ou du maïs. Les glucides sont élaborés par les plantes lors de
la photosynthèse à partir du dioxyde de carbone et de l’eau, en
utilisant l’énergie des rayonnements solaires. Par exemple, l’équation
de la réaction de photosynthèse du fructose et du glucose, tous deux de
formule brute C6H12O6 s’écrit :
6 CO2 + 6 H2O ---> C6H12O6 + 6 O2.
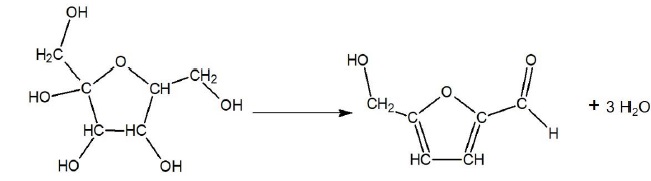
Cet exercice s’intéresse à une espèce chimique prometteuse synthétisée
à partir du fructose : le 2,5-diméthylfurane, noté DMF. Afin d’étudier
l’intérêt potentiel du DMF comme agrocarburant on se propose :
- d’analyser une partie de la synthèse du DMF à partir du fructose ;
- de déterminer le pouvoir calorifique du DMF.
Synthèse du 2,5-diméthylfurane (noté DMF)
La synthèse chimique du 2,5-diméthylfurane (noté DMF) à partir du
fructose comporte deux
transformations successives, la première conduisant à la synthèse d’un
produit intermédiaire, le 5-hydroxyméthylfurfural noté HMF. L’étude qui
suit porte sur cette première transformation.
Extrait d’un cahier de laboratoire :
Synthèse du produit intermédiaire HMF réalisée à partir du fructose
Étape (1) : on a introduit dans un ballon monocol rodé de 50 mL : 1,040 g de
fructose, 600 μL d’eau (solvant) ainsi que les catalyseurs : 150 mg de
résine Amberlyst 15TM et 3 g de TEAB. Les catalyseurs sont ajoutés pour
rendre plus rapide la transformation du fructose en HMF. Réalisation
d’un montage à reflux puis chauffage au bain-marie à l’ébullition.
Étape
(2) : une fois la transformation terminée, l’eau a été vaporisée (à
l’aide d’un appareil spécifique appelé évaporateur rotatif).
Étape (3) : on ajoute au milieu réactionnel de l’éthanol et de l’éthanoate d’éthyle
dans lesquels le HMF est soluble alors que la résine Amberlyst et le
TEAB ne sont pas solubles. Une filtration a permis de retirer la résine
Amberlyst et le TEAB du milieu réactionnel. On récupère le filtrat,
contenant de l’éthanol et de l’éthanoate d’éthyle (solvants organiques)
dans lequel est dissous le HMF. Les solvants du filtrat sont éliminés
par vaporisation (à l’aide de l’évaporateur rotatif). On a obtenu un
solide.
Étape (4) on a mesuré la masse du solide obtenu : m = 672 mg.
Étape (5) : on a réalisé les spectres infrarouges du fructose et du solide obtenu.
1.
Choisir, parmi les dix éléments de verrerie proposés ci-dessous, la
verrerie utile pour réaliser le montage de l’étape (1) de la synthèse
du HMF. Reporter sur votre copie le numéro de chaque élément de
verrerie choisi et préciser son nom.
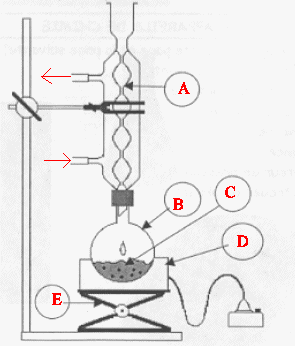
A : réfrigérant à eau ; : ballon ; D
: chauffe ballon ; E : élévateur à
croisillons.
|
| ..
... |
.
.
|
2.
Donner la nature de chacune des cinq étapes du protocole de synthèse du
HMF à l’aide de l’un des éléments de la liste suivante : transformation
du ou des réactifs, isolement du produit synthétisé, purification du
produit synthétisé, analyse du produit synthétisé.
Etape 1 : transformation du ou des réactifs.
Etape 2 : isolement du produit synthétisé.
Etape 3 : purification du produit synthétisé
Etape 5 : analyse du produit synthétisé.
3. Repérer dans le protocole expérimental, les transformations physiques pour lesquelles un apport d’énergie est nécessaire.
Lors de l'étape 1, chauffage à ébullition ; lors de l'étape 2,
vaporisation de l'eau ; lors de l'étape 3, vaporisation des solvants.
4. Justifier que la
réalisation du spectre infrarouge du solide obtenu permet de vérifier
la présence de HMF. Indiquer si la réalisation de ce spectre peut
permettre de vérifier aussi l’absence de fructose.
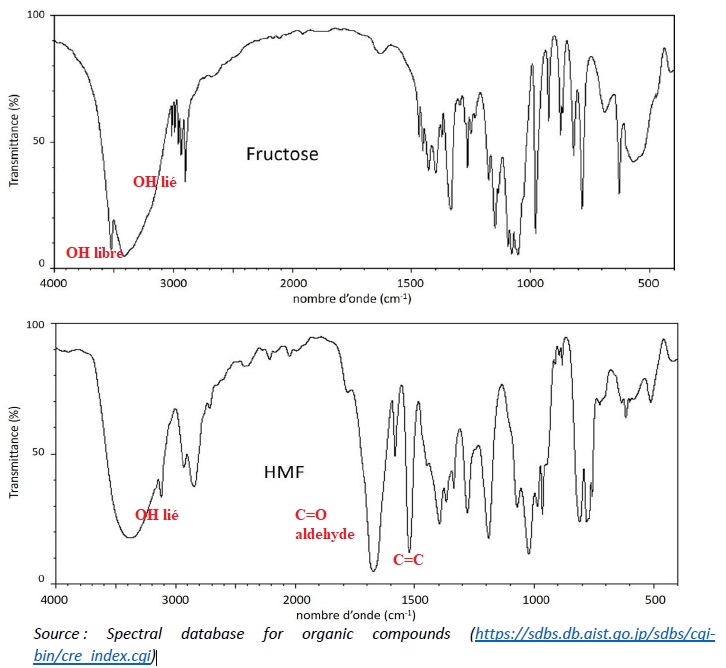
La présence du HFM est confirmé ( pics vers 1640 et 1700 cm-1).
Une large bande vers 3500 cm-1 peut être attribuée à la présence de fructose.
5. Déterminer la valeur de la masse molaire moléculaire du HMF.
M(C6H6O3) =6 x12 +6 +3 x18=138 g / mol.
6. En supposant que le solide obtenu est du HMF pur, déterminer le rendement de la synthèse du HMF à partir du fructose.
Quantité de matière de fructose : n = 1,040 / M(fructose) = 1,040 / 180,2 =5,77 10-3 mol.
Quantité de matière théorique de HMF : 5,77 10-3 mol.
Masse correspondante :5,77 10-3 x138=0,793g = 796 mg.
Rendement : 672 / 796 ~0,844 ( 84,4 %).
|
. .
|
Pouvoir calorifique du DMF.
Pour étudier l’intérêt potentiel d’un carburant, il est nécessaire de
disposer de ses caractéristiques énergétiques. Par exemple pour
l’éthanol, l’énergie molaire de sa combustion en phase gazeuse a pour
valeur 1,39 103 kJ·mol-1. Son pouvoir calorifique massique est PC(éthanol) = 30,2 103 kJ·kg-1 ; il s’agit de l’énergie que peut libérer un kilogramme d’éthanol lors de sa combustion complète.
7. Écrire l’équation de la réaction de combustion complète de l’éthanol, de formule brute C2H6O.
C2H6O + 3O2 ---> 2 CO2 + 3H2O.
La réaction de combustion complète du DMF a pour équation : C6H8O+ 7,5 O2→6 CO2+4 H2O
8. Établir le schéma de Lewis de la molécule de dioxyde de carbone (CO2) et de la molécule d’eau (H2O).
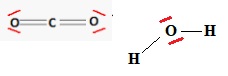
On cherche à déterminer l’énergie molaire de combustion Ecomb
du DMF en phase gazeuse. Pour cela on modélise le passage des réactifs
aux produits par un état dans lesquels les molécules ont été
entièrement dissociées en atomes, les énergies des liaisons étant alors
mises en jeu. Le schéma ci-dessous est une représentation du modèle
utilisé.
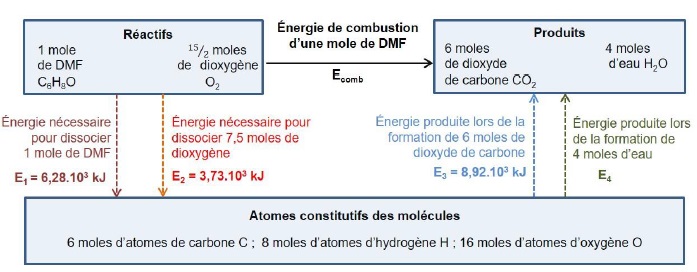
9. Déterminer l’énergie E4 produite lors de la formation de 4
moles d’eau à partir des atomes constitutifs de ces molécules, sachant
que l’énergie molaire de la liaison O-H est égale à 463 kJ·mol-1.
E4 = 8 x463 =3704 kJ.
10. En déduire l’énergie molaire de combustion du DMF.
Ecomb =E1 +E2 -E3 -E4 = (6,28 +3,73 -8,92 -3,7) 103 = - 2,61 103 kJ mol-1.
Le signe moins traduit le fait que le système cède de l'énergie au milieu extérieur.
11. Montrer que le pouvoir calorifique massique du DMF a pour valeur PC(DMF) = 27,2 103 kJ·kg-1.
2,61 103 x1000 / M(DMF) =2,61 103 x1000 / 96,1 ~27,2 103 kJ·kg-1.
|
Conclusion à propos de la problématique.
12. À l’aide des informations fournies, des études effectuées dans
cette partie à propos de l’éthanol et du DMF ainsi que de vos
connaissances, discuter en une dizaine de lignes des principaux
avantages et inconvénients des agrocarburants.
Avantages :
respect de l'environnement ( émet moins de fumées, pas de soufre), ne
contribue pas à l'effet de serre ( moins d'émission de CO2 que les carburants classiques).
L'utilisation de biocarburants peut permettre le développement du secteur agricole.
Les biocarburants apportent une plus grande sécurité dans les
approvisionnement d'énergie. ( achat de pétrole dans des pays
plus ou moins stables).
Elle évite une exportation d'argent si les cultures de betteraves, colza et tournesol sont locales.
Inconvénient : pollution des sols et des eaux ( engrais, fongicides utilisés en grand nombre en agriculture intensive).
Sur la terre, il n'y a pas suffisamment de place pour les cultures vivrières et les cultures conduisant aux biocarburants.
De plus les coûts de production sont deux fois plus élevés que ceux d'un carburant pétrolier.
|
|
|




