Physique
chimie, centrale électrique de l'ouest guyanais ( CEOG) ;
qui peut griller une tranche de pain en pédalant ?
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Centrale
électrique de l'ouest guyanais.
Le projet consiste à associer une centrale photovoltaïque à une
centrale à dihydrogène.
L’énergie électrique non consommée produite par la centrale
photovoltaïque en journée, est utilisée pour réaliser l’électrolyse de
l’eau pour produire du dihydrogène. Ce dihydrogène est alors stocké sur
place pour pouvoir être utilisé la nuit dans une pile à combustible.
La première partie de l’exercice est consacrée à la production et au
stockage du dihydrogène.
La deuxième partie est consacrée au fonctionnement électrique d’un
électrolyseur.
Partie 1. Production et
stockage du dihydrogène.
On cherche dans un premier temps à dimensionner les différents
réservoirs à utiliser pour stocker le dihydrogène produit par la
centrale à dihydrogène.
Les couples d’oxydo-réduction mis en jeu pour l’obtention de
dihydrogène lors de l’électrolyse de l’eau sont les suivants :
- O2 (g) / H2O(l)
- H+ (aq) / H2 (g)
1.1. Définir un
oxydant et un réducteur.
Un oxydant est une espèce, ion ou molécule, susceptible de gagner un ou
plusieurs électrons.
Un réducteur est une espèce, ion ou
molécule, susceptible de donner un ou plusieurs électrons.
1.2.1. Écrire les
demi-équations électroniques associées aux deux couples mis en jeu.
2H+ (aq) + 2e-
= H2 (g).
½O2 (g) + 2H+ (aq) + 2e-
= H2O(l).
1.2.2.
L’électrolyse de l’eau est modélisée par la réaction d’équation :
2 H2O(l ) → 2 H2(g) + O2(g)
L’électrolyseur devra permettre de produire une masse de 50 kg de
dihydrogène en journée.
Déterminer la valeur de la quantité de matière de dihydrogène à
produire n(H2) en journée.
n(H2) = 50 103 / M(H2) = 5,0 104
/ 2 = 2,5 104 mol.
1.2.3. Calculer la
masse d’eau m(H2O) nécessaire pour produire les 50 kg de
dihydrogène à stocker durant la journée.
n(eau) = n(H2) ; masse d'eau : 2,5 104 x M(H2O)
= 2,5 104 x18 = 4,5 105 g = 4,5 102 kg.
1.2.4. Déterminer
le volume minimum du réservoir d’eau V(H2O).
m(eau) / masse volumique de l'eau = 450 / 1000 = 0,45 m3.
1.3.1. Le stockage
du dihydrogène s’effectue quant à lui généralement avec des bouteilles
ou assemblages de bouteilles cylindriques, en acier, portées à une
pression Pstock de 5,0×10 6 Pa.
En utilisant la loi de Mariotte, déterminer le volume nécessaire Vstock
des bouteilles pour stocker le dihydrogène.
P V = Constante ( loi de Mariotte).
Pstock
Vstock
=Patm n(H2)Vm.Vstock =Patm
n(H2)Vm / Pstock= 1,0 105
x 24 10-3 x 2,5 104 / (5,0 106)
=12 m3.
1.3.2.
Commenter les résultats sachant que le parc photovoltaïque s’étend sur
une surface de 700 000 m ².
Le volume de stockage du dihydrogène est très faible, comparé à
l'étendue du parc photovoltaïque.
Partie 2. Étude du
fonctionnement électrique d’un électrolyseur.
On cherche maintenant à caractériser le fonctionnement électrique d’un
électrolyseur pouvant servir à produire du dihydrogène.
L’électrolyse de l’eau est réalisée au laboratoire à l’aide du montage
électrique suivant.
En faisant varier la tension U aux bornes de l’électrolyseur, on mesure
pour chaque valeur de la tension U, l’intensité du courant I dans le
circuit de l’électrolyseur.
La caractéristique représentant l’évolution de la tension U aux bornes
de l’électrolyseur en fonction de l’intensité du courant I, est
représentée ci-dessous.
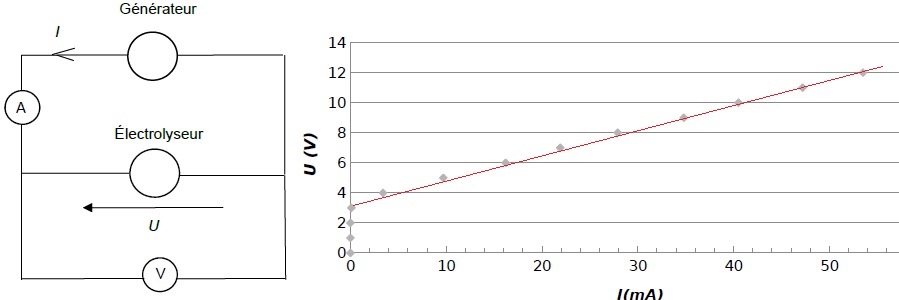
Une partie de la courbe obtenue est modélisable par l’équation U = E’ +
r’.I où :
E’ est la force contre-électromotrice de l’électrolyseur exprimée en
volt (V) ;
r’ est la résistance interne de l’électrolyseur exprimée en ohm (W).
Équation de la droite déterminée à l’aide d’un logiciel de calcul : U =
3,46 + 160 × I où U exprimée en V et I en A.
2.1. Donner la
forme d’énergie à faire apparaître dans chaque cadre de la chaîne
énergétique suivante :
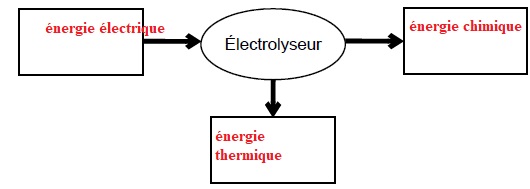
2.3.1. Donner
l’expression littérale de l’énergie totale reçue Ereçue par
l’électrolyseur s’il fonctionne pendant une durée Dt en fonction de U, I et Dt.
Ereçue = U I Dt.
2.3.2. Donner
l’expression littérale de l’énergie totale dissipée Edissipée
par l’électrolyseur sous forme d’effet Joule s’il fonctionne pendant
une durée Dt.
Erdissipée
= r I2 Dt.
2.3.3.
En déduire que l’expression littérale du rendement de l’électrolyseur
est η = E' / U.
Energie utile = E' I Dt.
Rendement = énergie utile / énergie consommée = E' I Dt
/ (U
I Dt)
= E' / U
2.3.4.
Calculer le rendement de cet électrolyseur pour un courant d’intensité
I = 50 mA.
U
= 3,46 + 160 × I = 3,46 + 160 x 0,050 = 11,46 V.
Rendement : 3,46 / 11,46 ~0,30 ( 30 %).
2.4. En s’appuyant sur les données
de l’énoncé et les réponses aux questions précédentes, expliquer en
quoi le projet semble être une bonne alternative aux énergies fossiles.
La production électrique ( 10 MW le jour et 3,0 MW la nuit ) est
stable et équivalente à la production des centrales thermiques
fonctionnant au diesel ou au gaz. Le prix de l'électricité est
inférieur à celui des centrales thermiques. De plus, il n'y a pas de
pollution, pas de logistique d'approvisionnement en carburant.
|
|
Qui peut griller une tranche de pain en pédalant ?
L’énergie
musculaire du cycliste est transformée en électricité grâce à une
dynamo actionnée par la rotation du pédalier. L’ensemble alimente un
grille-pain. Pour que l’appareil fonctionne, il faut que le champion
produise une puissance de 700 W. Deux minutes plus tard, le cycliste a
fourni au
grille-pain 0,021 kWh (76 kJ) suffisant pour sortir une tranche légèrement brunie.
1. Performance de Robert Förstemann.
1.1. Schématiser la chaîne énergétique de la dynamo du vélo utilisé par Robert Förstemann.
On suppose que le rendement de cette dynamo n’est pas de 100 %.
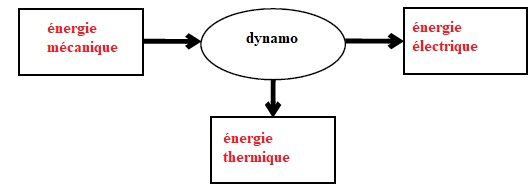
1.2. Le grille-pain
est conçu pour fonctionner normalement sous une tension de 230 V et
pour fournir une puissance de 700 W. Montrer que la valeur de
l’intensité du courant qui traverse le grille-pain en fonctionnement
normal est d’environ 3 A.
I = P / U = 700 / 230 =,04 ~3,0 A.
1.3.Nommer l’effet
responsable de l’élévation de température dans le grille-pain. Déduire
de la question précédente la valeur de la résistance R du circuit
électrique de cet appareil.
Le pain est chauffé par effet Joule.
P = R I2 ; R = P / I2 = 700 / 3,02 ~77,8 ~78 ohms.
Une simulation de la caractéristique du circuit électrique du grille-pain est donnée ci-dessous.
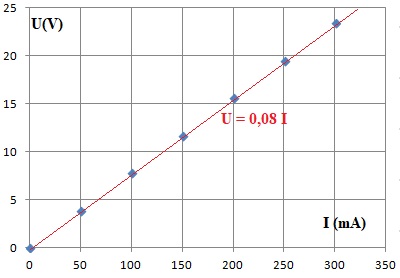
Elle relie la tension U appliquée à l’intensité du courant électrique I qui traverse le circuit électrique du grille-pain.
1.4. Indiquer la
loi qui modélise la caractéristique du circuit électrique du
grille-pain, retrouver la valeur de la résistance du circuit électrique
du grille-pain et comparer le résultat à celui de la question
précédente.
Loi d'Ohm U = R I = 0,08 I avec U en V et I en mA.
R = 0,08 kW= 80 ohms.
Ecart relatif ( 80 -78) / 78 ~0,03 ( 3 %).
Les deux résultats sont en accord.
1.5. Déterminer la
valeur de la puissance moyenne fournie par Robert Forstemann. Estimer,
en prenant R = 76 Ω, la valeur moyenne de la tension et de celle de
l’intensité du courant de fonctionnement du grille-pain durant la
performance. Commenter.
Pmoyenne = énergie (J) / durée (s) = 76 103 / (2 x60) ~6,3 102 W.
P = U I avec U = R I ; P = R I2 ; I =(P / R)½ =(6,3 102 / 76)½~ 2,9 A ; U = 76 x 2,9 ~2,2 102 V.
1.6. Estimer, en
effectuant un bilan énergétique, la valeur de la vitesse maximale que
pourrait atteindre le cycliste à vélo initialement immobile en 5
secondes sur un terrain plat en développant une puissance de 630 W.
Commenter.
Energie mise en oeuvre : 630 x 5 = 3 150 J.
Cette énergie est convertie en énergie cinétique : ½mv2 = 3150 avec m = 60 kg par exemple.
v2 = 2 x 3150 / 60 =105 ; v ~10 m /s. ( 36 km / h).
|
2. Récupérer après l’effort
Après un effort intense, tel que celui fourni par Robert
Förstemann, l'organisme a besoin de glucides simples tels que le
saccharose, appelés sucres rapides, disponibles rapidement pour
reconstituer les ressources en énergie de l'organisme. Dans cette
partie, nous cherchons à déterminer la quantité nécessaire de sucre
(saccharose) à ingérer pour récupérer après l’effort
fourni par Robert Förstemann.
Le saccharose, sucre de table habituel, est un composé organique de formule brute C12H22O11.
Son assimilation par l’organisme s’effectue après son hydrolyse
(réaction avec l’eau du saccharose) qui forme du glucose et du
fructose, deux sucres de même formule brute.
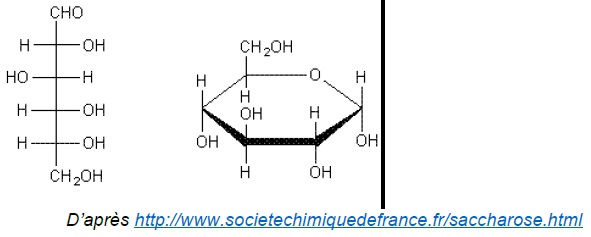
La molécule de glucose peut adopter une configuration à chaîne ouverte
ou cyclique, comme l’illustre les deux représentations du glucose
suivantes :
2.1. Le spectre infrarouge obtenu par analyse d’un échantillon de glucose est fourni ci-dessous.
Déduire de ce spectre la configuration majoritaire du glucose dans l’échantillon étudié. Justifier.
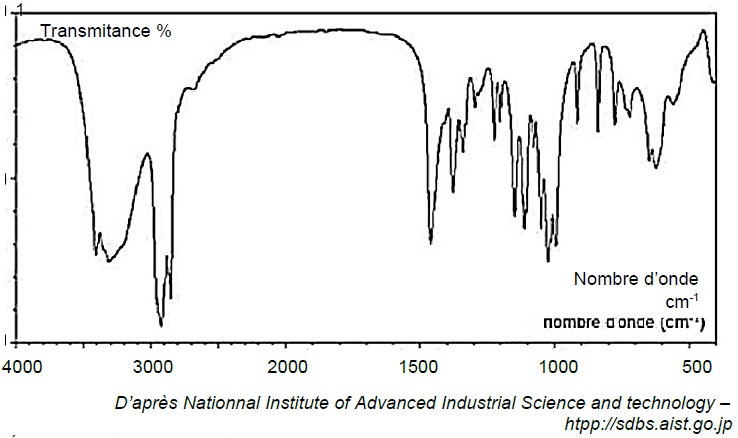
L'absence du pic caractéristique du groupe carbonyle C=O vers 1700 cm-1, implique que la forme cyclique du glucose est très majoritaire.
2.2. Écrire l’équation de la réaction modélisant l’hydrolyse du saccharose.
C12H22O11 + H2O ---> 2 C6H12O6.
2.3.Vérifier que l’oxydation complète d’un morceau de sucre libère une énergie d’environ 24 kcal.
L’énergie molaire fournie par la combustion (oxydation complète) du saccharose est 5,8×106 J·mol-1 ;
une boîte de sucre de masse nette m = 1,0 kg contient 168 morceaux ; masse d'un morceau de sucre : 1000 / 168 = 5,92 g.
Quantité de matière = 5,92 / M(saccharose) = 5,92 / (12 x12 +22 +11 x16) = 5,92 / 342 =0,0173 mol.
Energie correspondante : 0,0173 x 5,8 106 =100 398 J ~ 100,4 kJ soit 100,4 / 4,18 = 24 kcal.
2.4.En
déduire la quantité de sucre que Robert Förstemann doit ingérer pour
compenser l’effort réalisé en supposant que l’énergie musculaire a été
intégralement transférée au grillepain.
Commenter.
Energie consommée en pédalant : 76 kJ.
Energie fournie par l'oxydation d'un morceau de sucre : 24 kcal soit 24 x4,18 ~100 kJ.
Il lui faudrait consommer environ les 3 / 4 d'un morceau de sucre.
Dans la réalité, toute l'énergie musculaire n'est pas transférée au
grille-pain. Il lui faudra donc sans doute consommer plusieurs morceau
de sucre pour récupérer.
|
|
|





